政策法規(guī) || 《化學(xué)藥生物等效性試驗(yàn)備案范圍和程序(征求意見稿)》(附法規(guī)概覽10.21-11.01)
01
關(guān)于公開征求《化學(xué)藥生物等效性試驗(yàn)備案范圍和程序(征求意見稿)》意見的通知
為優(yōu)化生物等效性試驗(yàn)(BE)備案有關(guān)工作,明確BE試驗(yàn)備案范圍,完善BE備案工作程序,經(jīng)廣泛調(diào)研和討論,我中心組織更新了《化學(xué)藥生物等效性試驗(yàn)備案范圍和程序》,現(xiàn)形成征求意見稿。

掃描圖中二維碼
查看詳細(xì)信息

02
關(guān)于公開征求《口服藥物胃pH依賴性藥物相互作用評(píng)價(jià)技術(shù)指導(dǎo)原則(征求意見稿)》意見的通知國(guó)家藥監(jiān)局
為指導(dǎo)在口服藥物研發(fā)過程中評(píng)估與抑制胃酸藥物合用的pH依賴性藥物相互作用風(fēng)險(xiǎn),提高研發(fā)效率,我中心組織起草了《口服藥物胃pH依賴性藥物相互作用評(píng)價(jià)技術(shù)指導(dǎo)原則(征求意見稿)》,現(xiàn)公開征求意見。

掃描圖中二維碼
查看詳細(xì)信息

03
關(guān)于發(fā)布仿制藥參比制劑目錄(第八十四批)及調(diào)出參比制劑目錄品種清單(第一批)的通告(2024年第46號(hào))
經(jīng)國(guó)家藥品監(jiān)督管理局仿制藥質(zhì)量和療效一致性評(píng)價(jià)專家委員會(huì)審核確定,現(xiàn)發(fā)布仿制藥參比制劑目錄(第八十四批)及調(diào)出參比制劑目錄品種清單(第一批)。

掃描圖中二維碼
查看詳細(xì)信息

01
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《氟[18F]化鈉注射液仿制藥藥學(xué)研究技術(shù)要求(試行)》的通告(2024年第44號(hào))

掃描圖中二維碼
查看詳細(xì)信息

02
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《已上市境外生產(chǎn)藥品轉(zhuǎn)移至境內(nèi)生產(chǎn)的藥品上市注冊(cè)申請(qǐng)申報(bào)資料要求(預(yù)防用生物制品)》的通告(2024年第43號(hào))

掃描圖中二維碼
查看詳細(xì)信息

03
關(guān)于對(duì)創(chuàng)新藥以及經(jīng)溝通交流確認(rèn)可納入優(yōu)先審評(píng)審批程序和附條件批準(zhǔn)程序的品種開展受理靠前服務(wù)的通知

掃描圖中二維碼
查看詳細(xì)信息

04
關(guān)于將羥鈷胺注射液納入《以患者為中心的罕見疾病藥物研發(fā)試點(diǎn)工作計(jì)劃(“關(guān)愛計(jì)劃”)》試點(diǎn)項(xiàng)目的公示

掃描圖中二維碼
查看詳細(xì)信息

05
關(guān)于將Marstacimab納入《以患者為中心的罕見疾病藥物研發(fā)試點(diǎn)工作計(jì)劃(“關(guān)愛計(jì)劃”)》試點(diǎn)項(xiàng)目的通知
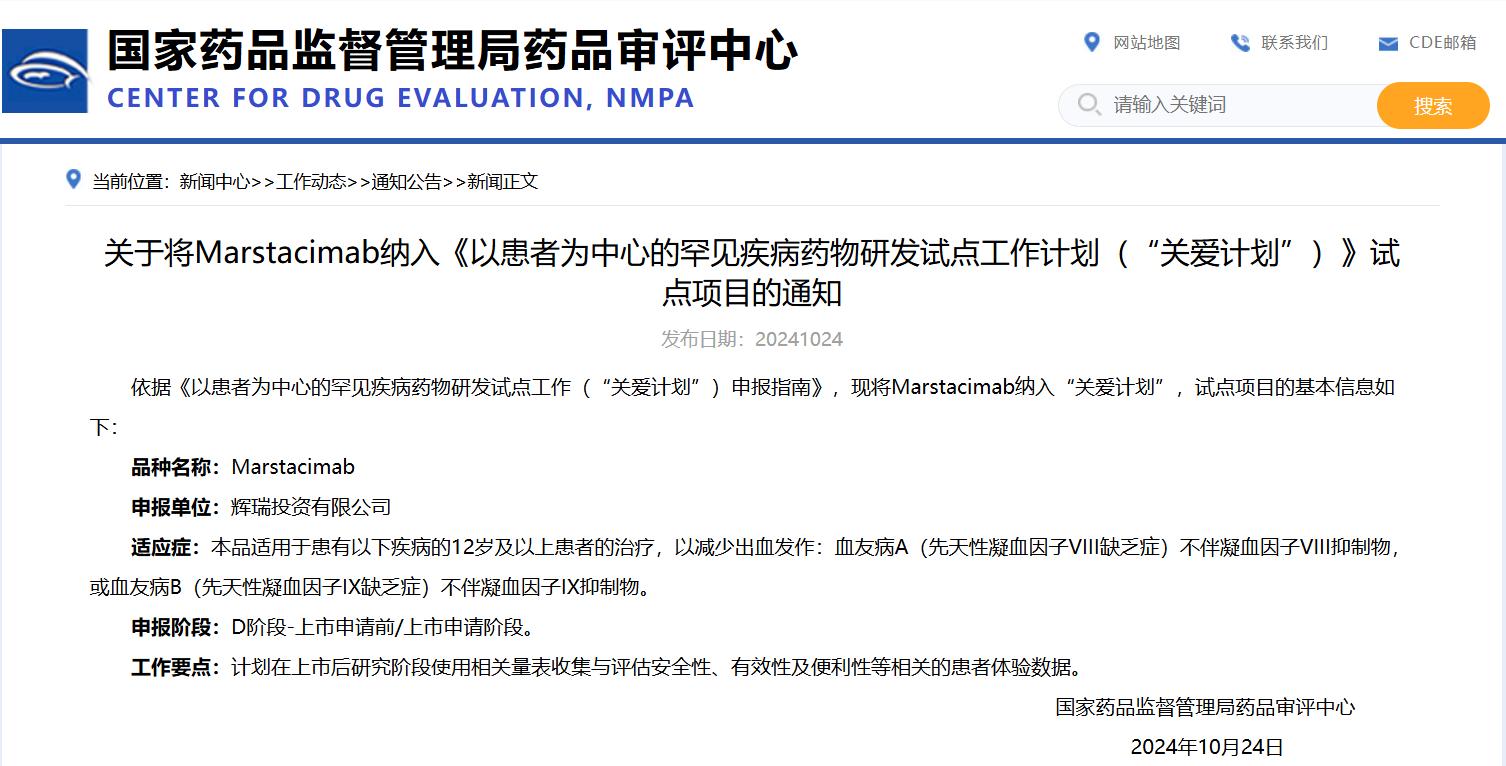
掃描圖中二維碼
查看詳細(xì)信息

06
關(guān)于將Fitusiran 注射液納入《以患者為中心的罕見疾病藥物研發(fā)試點(diǎn)工作計(jì)劃(“關(guān)愛計(jì)劃”)》試點(diǎn)項(xiàng)目的公示

掃描圖中二維碼
查看詳細(xì)信息

07
關(guān)于公開征求《中藥復(fù)方制劑新藥研發(fā)人用經(jīng)驗(yàn)信息收集整理技術(shù)指導(dǎo)原則(征求意見稿)》意見的通知

掃描圖中二維碼
查看詳細(xì)信息

08
關(guān)于公開征求《藥物濃度-QTc臨床研究技術(shù)指導(dǎo)原則(征求意見稿)》意見的通知

掃描圖中二維碼
查看詳細(xì)信息

09
關(guān)于公開征求《抗體偶聯(lián)藥物臨床藥理學(xué)研究技術(shù)指導(dǎo)原則(征求意見稿)》意見的通知

掃描圖中二維碼
查看詳細(xì)信息

10
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《可復(fù)制型慢病毒檢測(cè)共性問題與技術(shù)要求》的通告(2024年第45號(hào))

掃描圖中二維碼
查看詳細(xì)信息

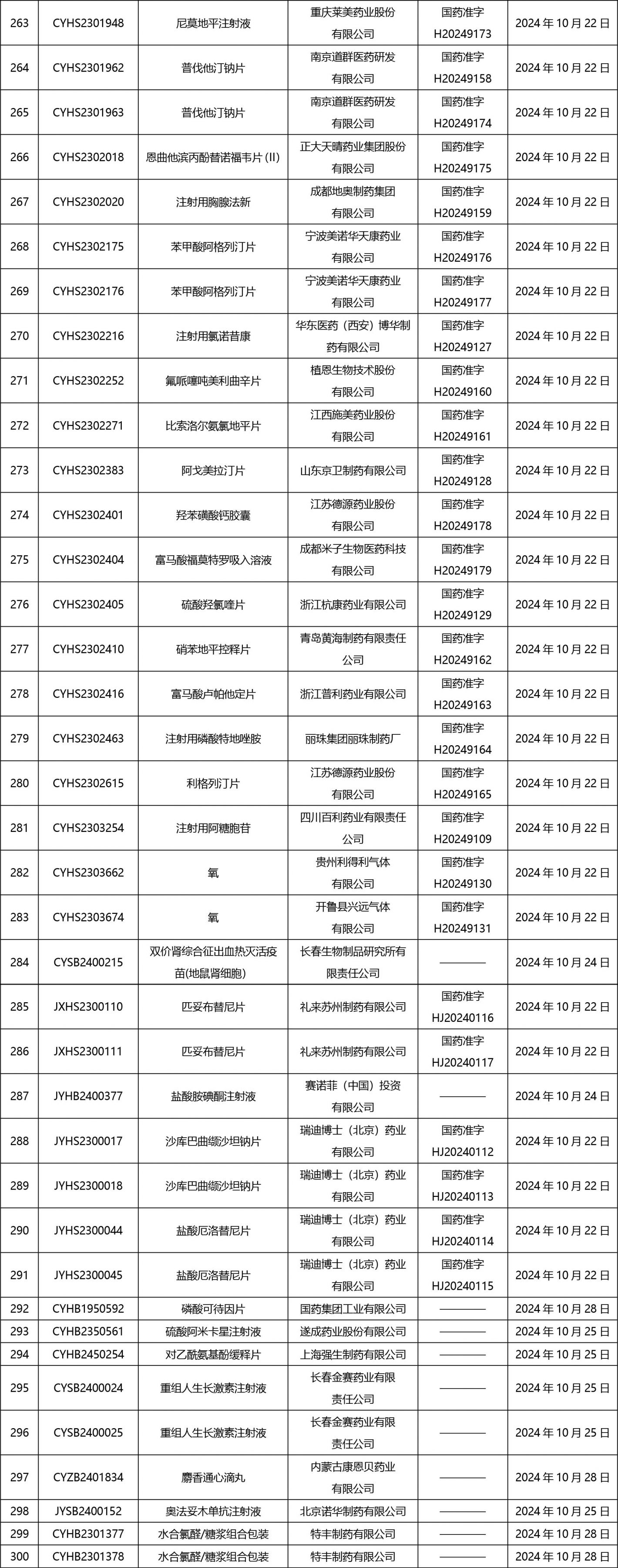
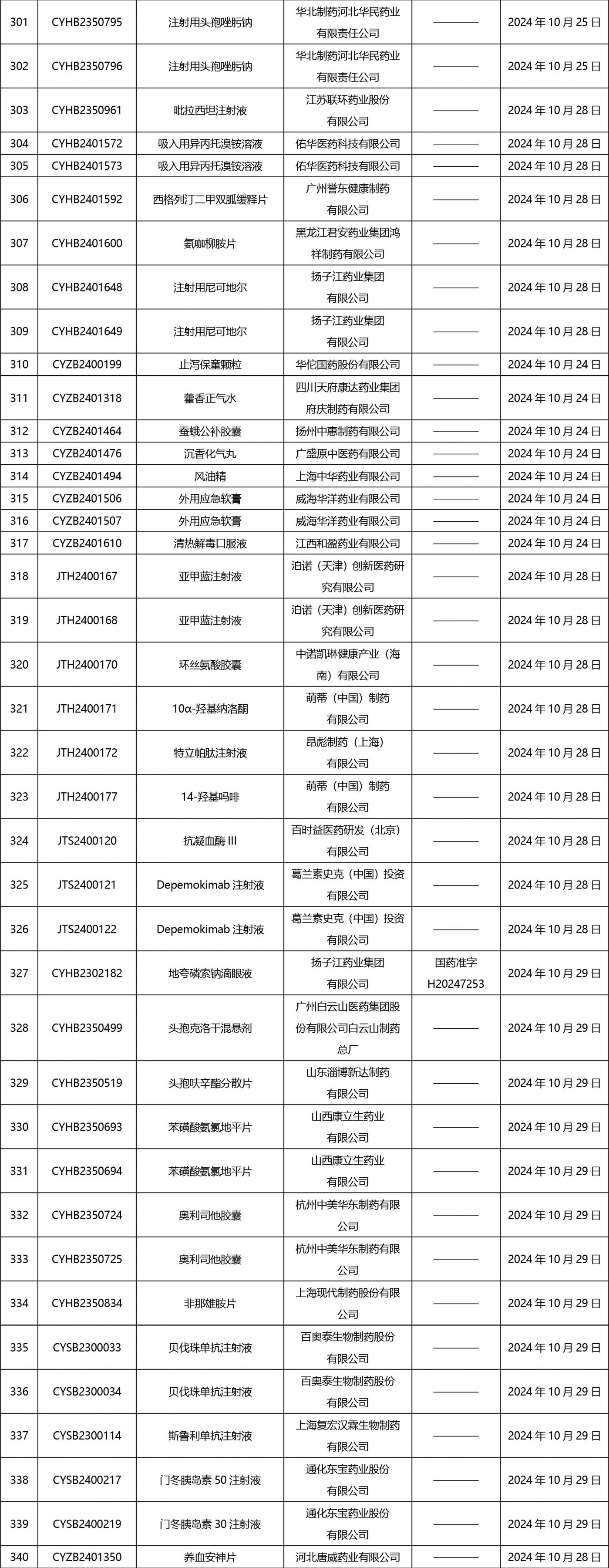
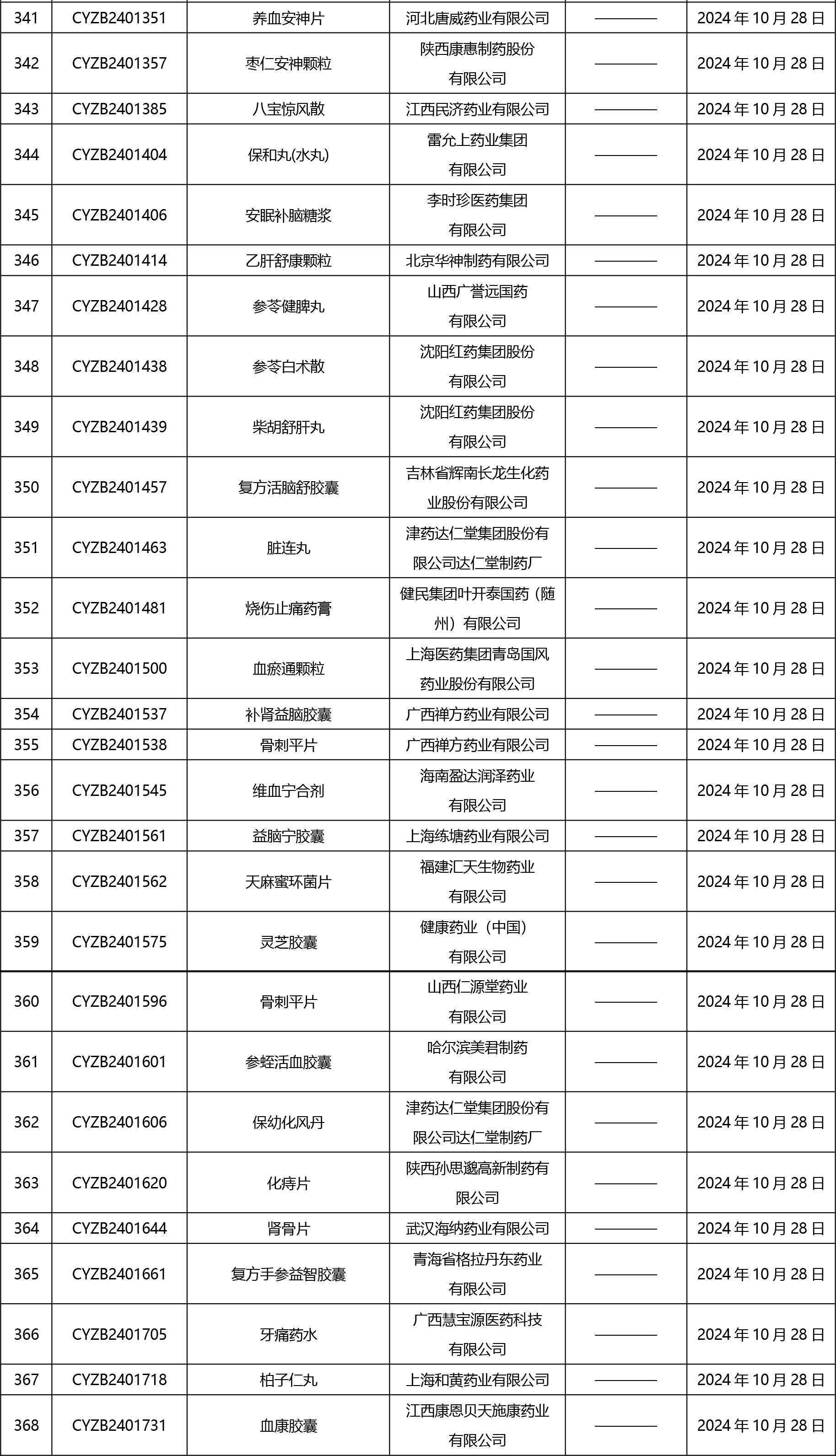
2024年10月21日至2024年11月1日 16:00發(fā)布368個(gè)待領(lǐng)取藥品批準(zhǔn)證明文件,其中注射液125個(gè),一致性評(píng)價(jià)品種45個(gè)。
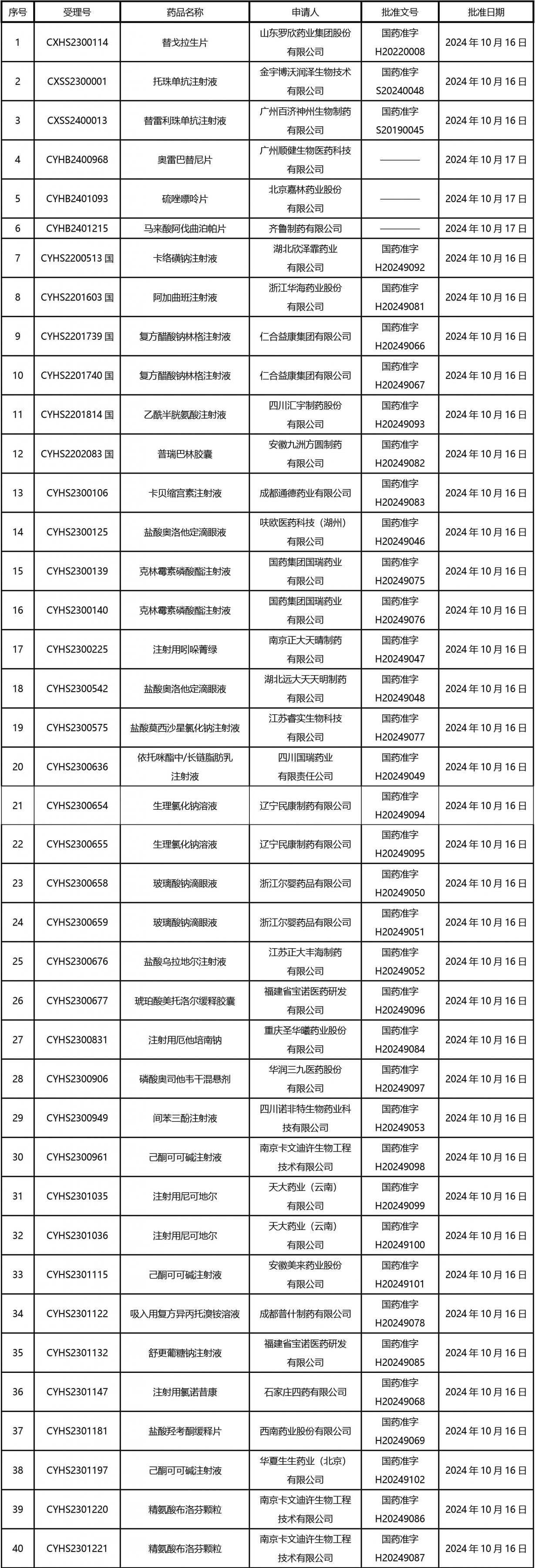
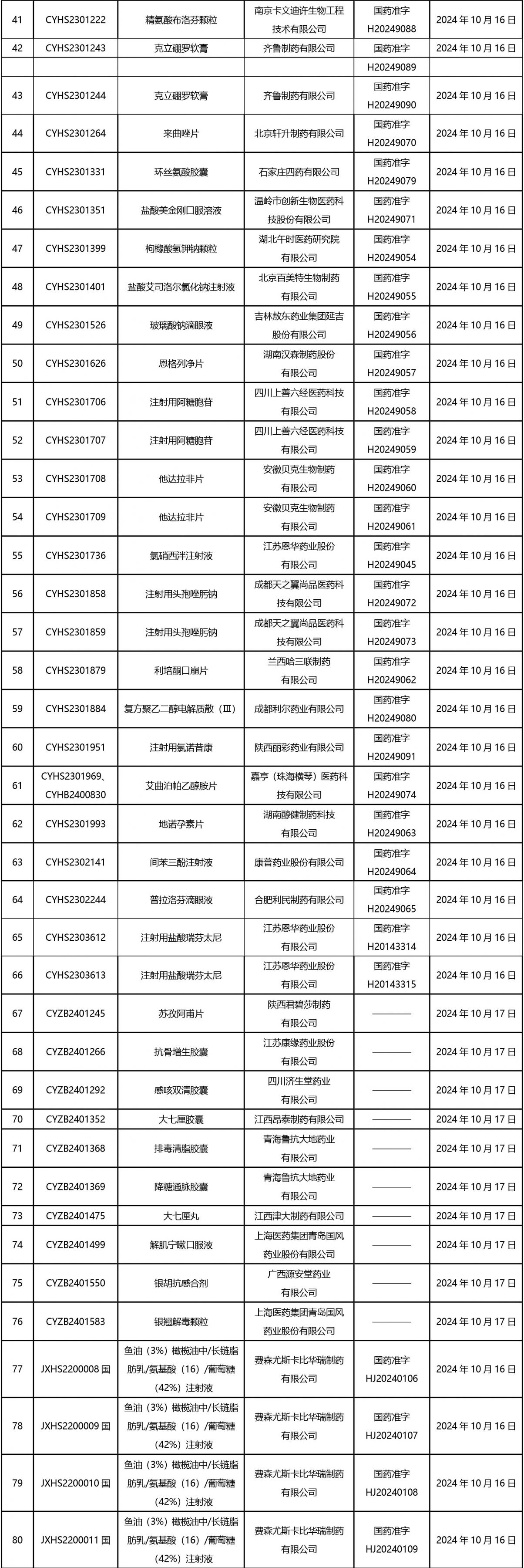
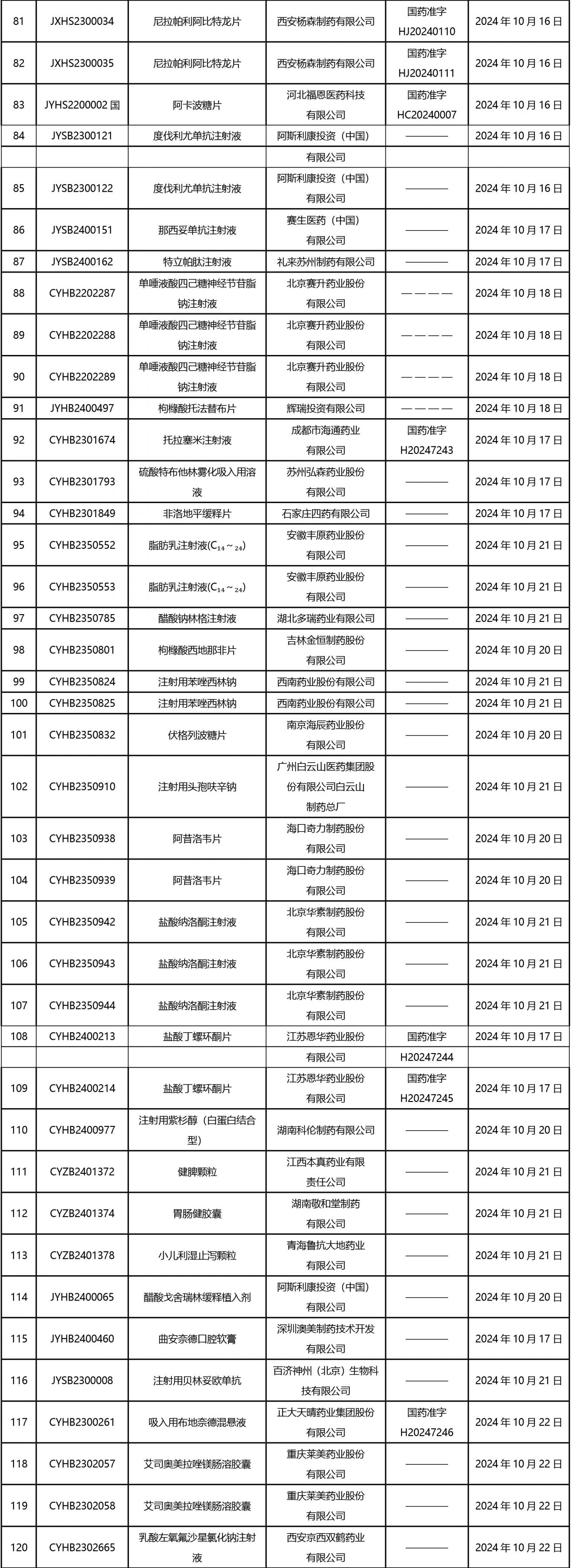
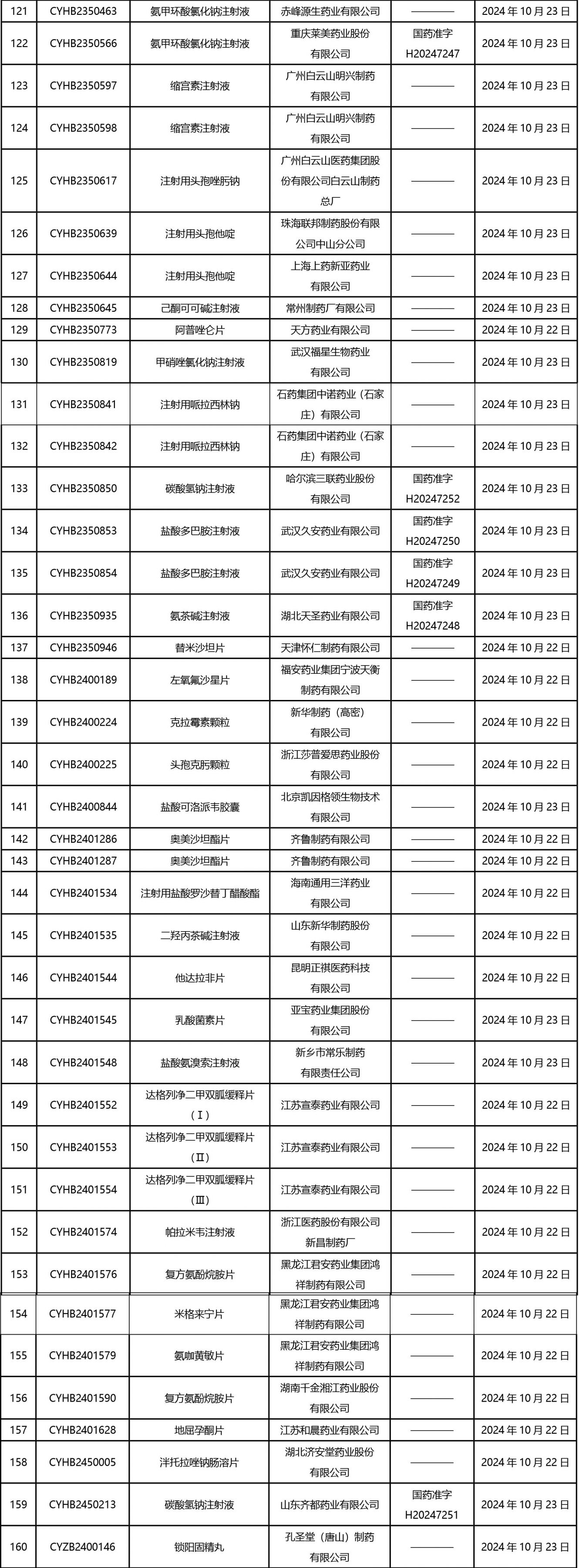
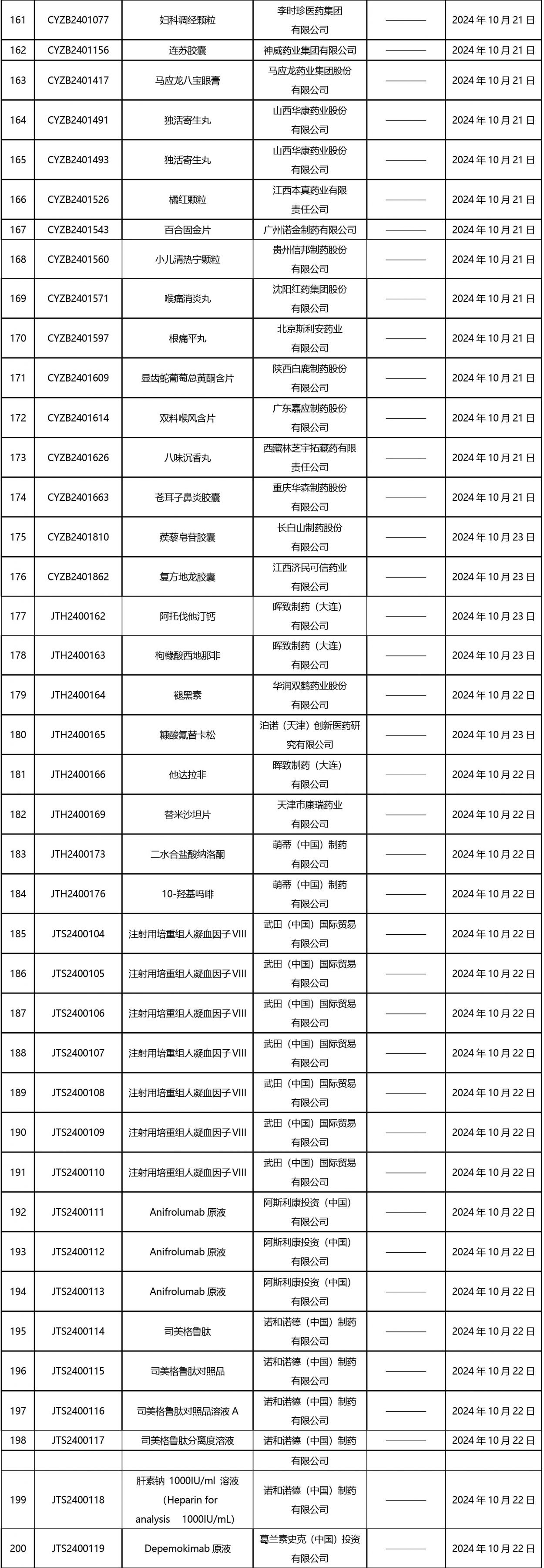
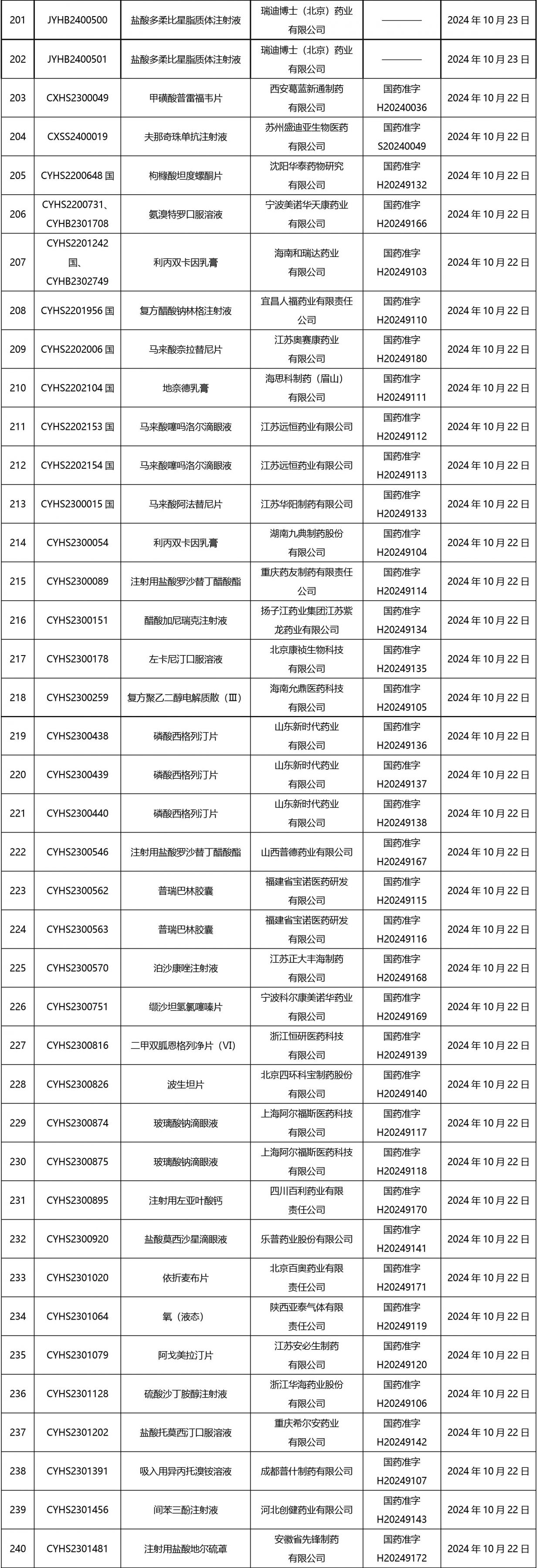
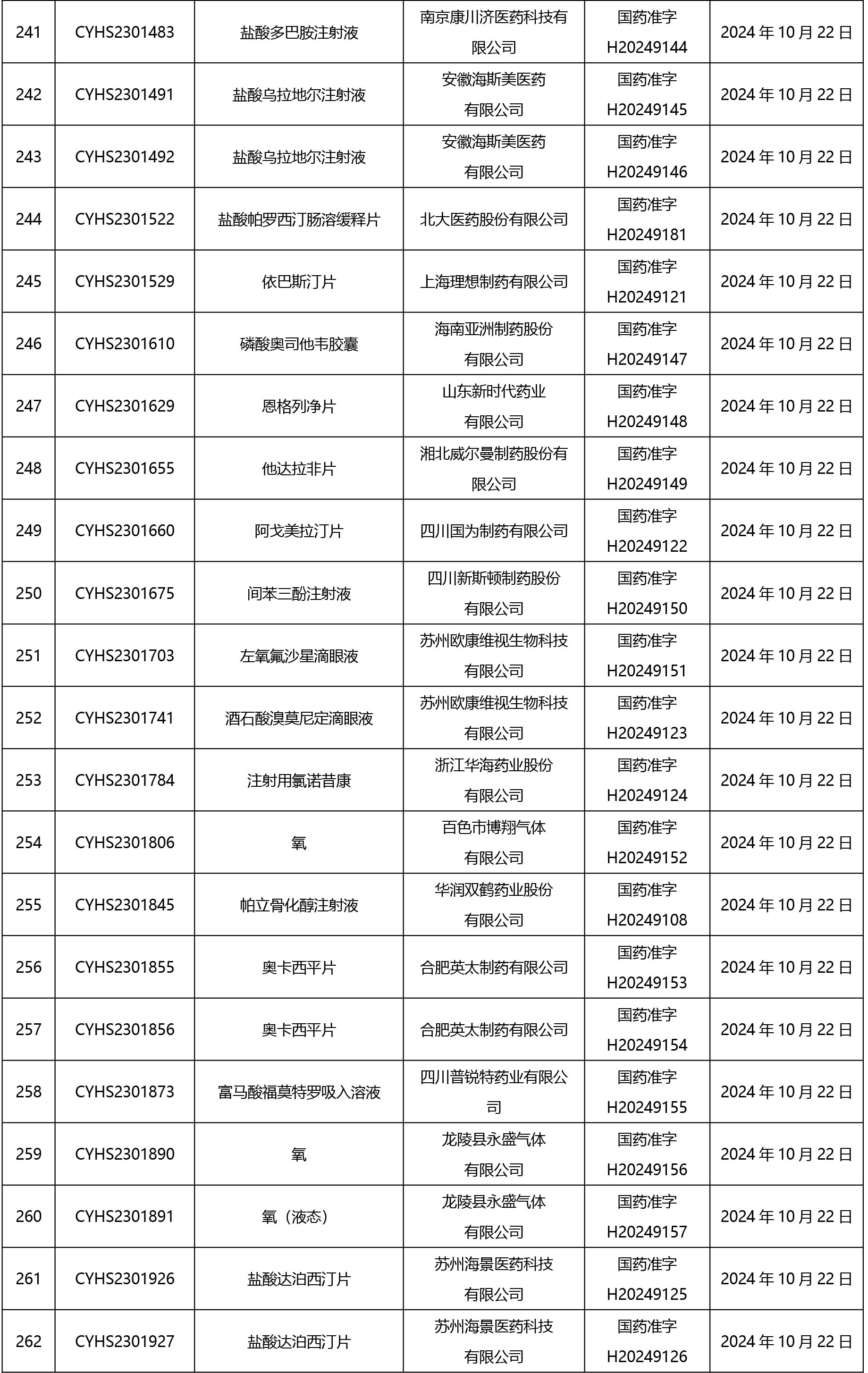
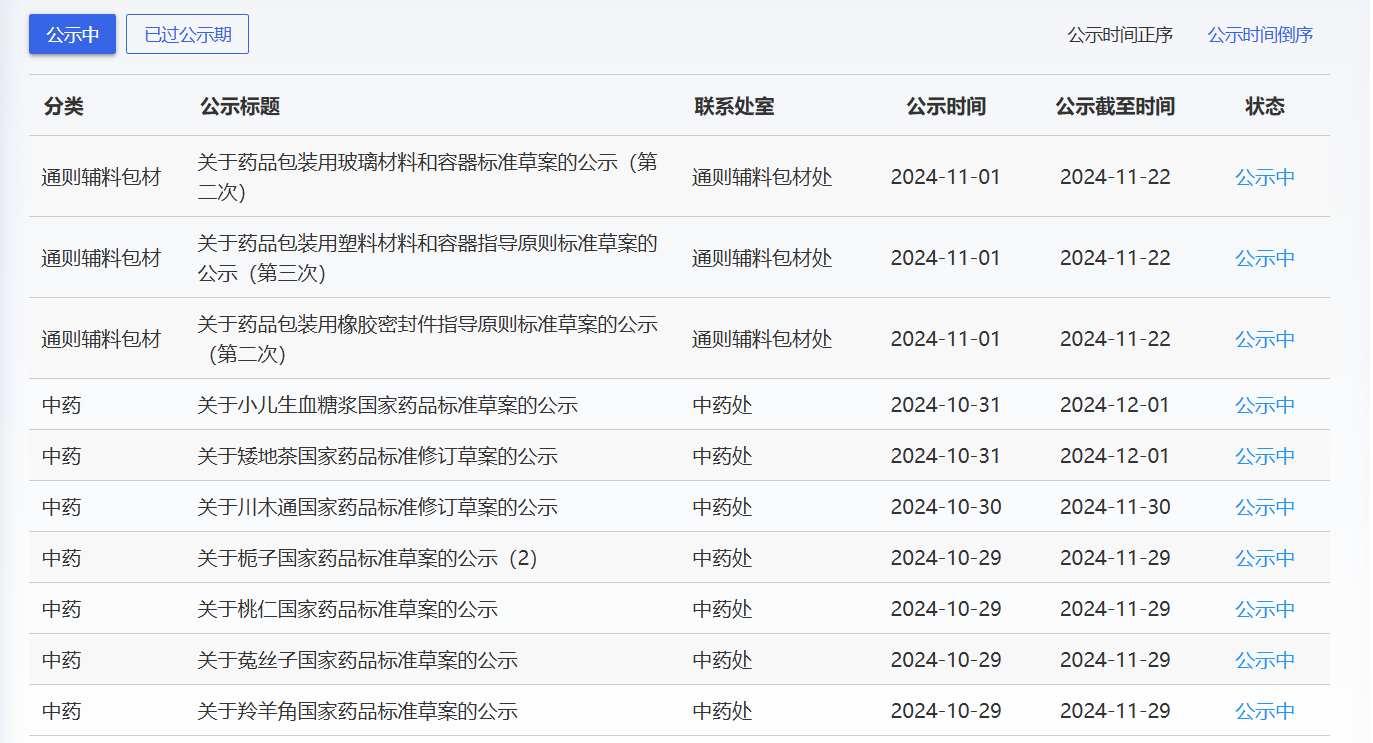
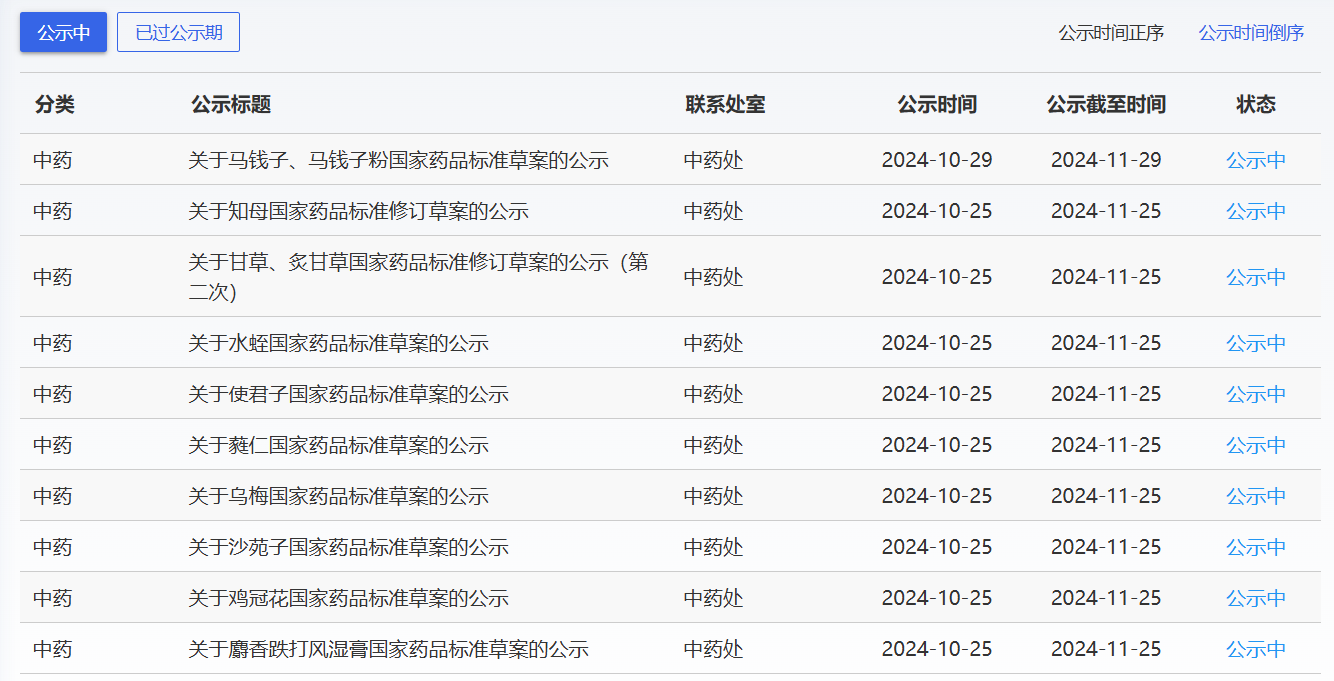
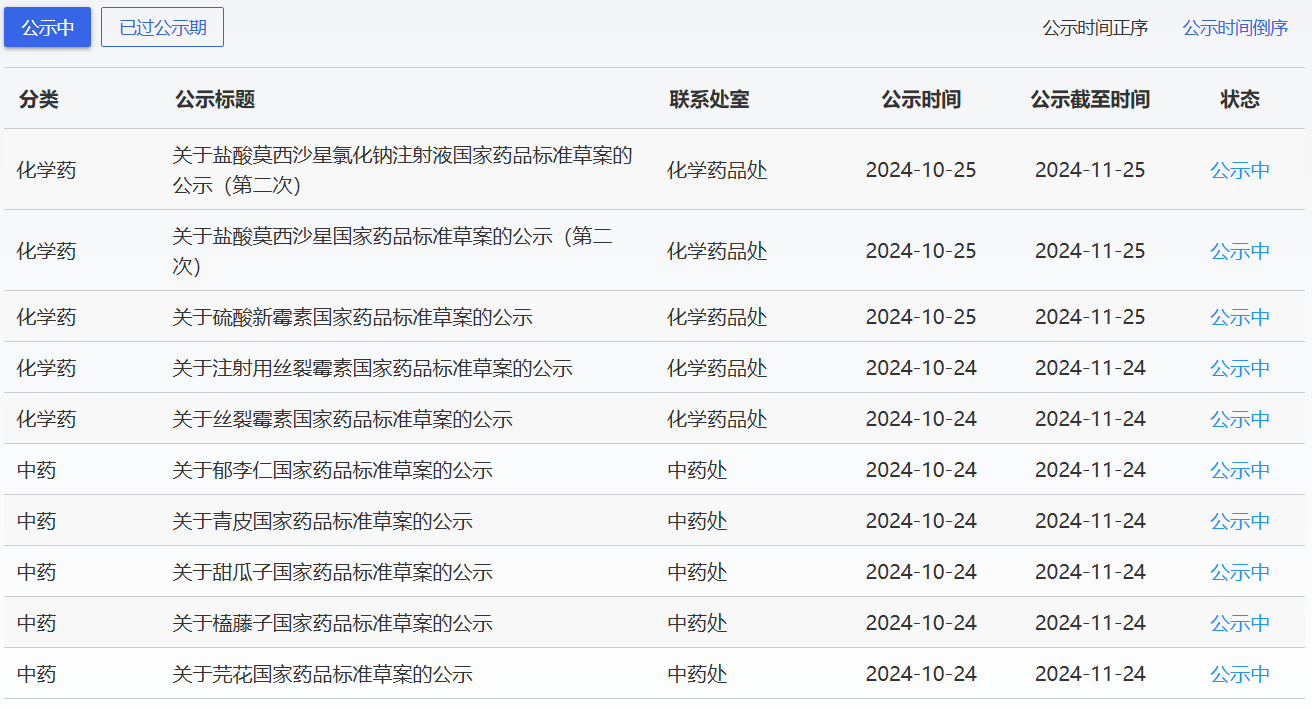
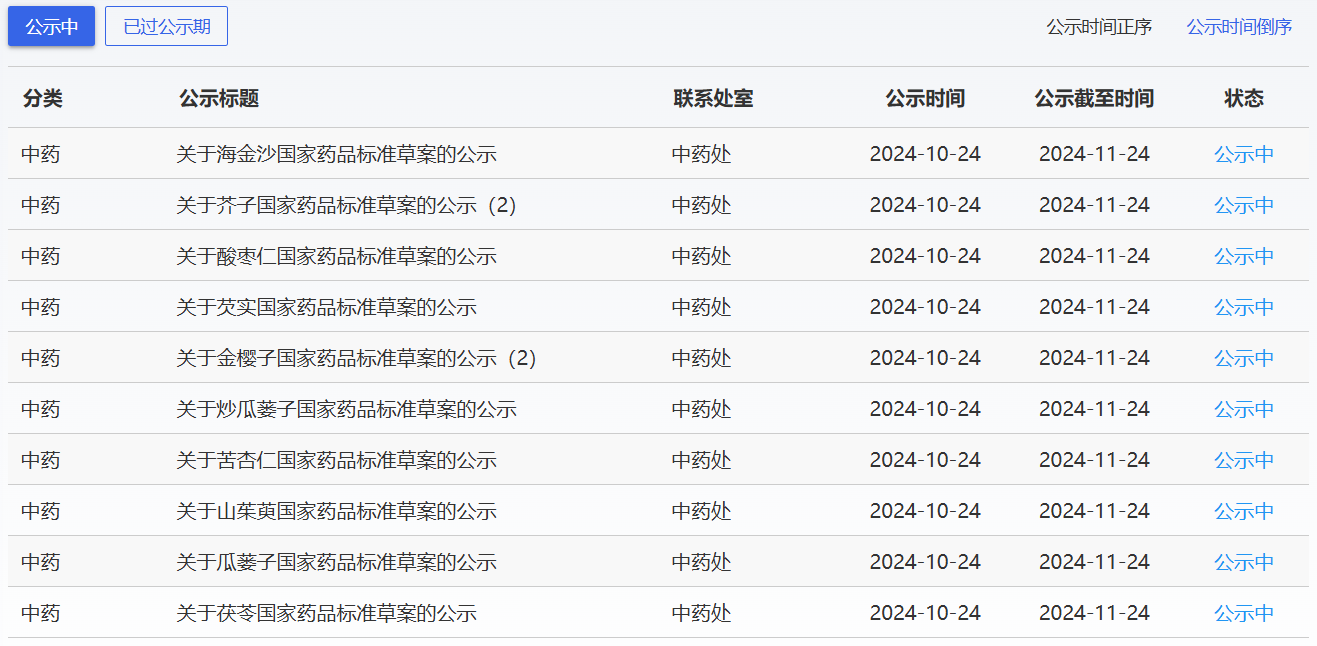
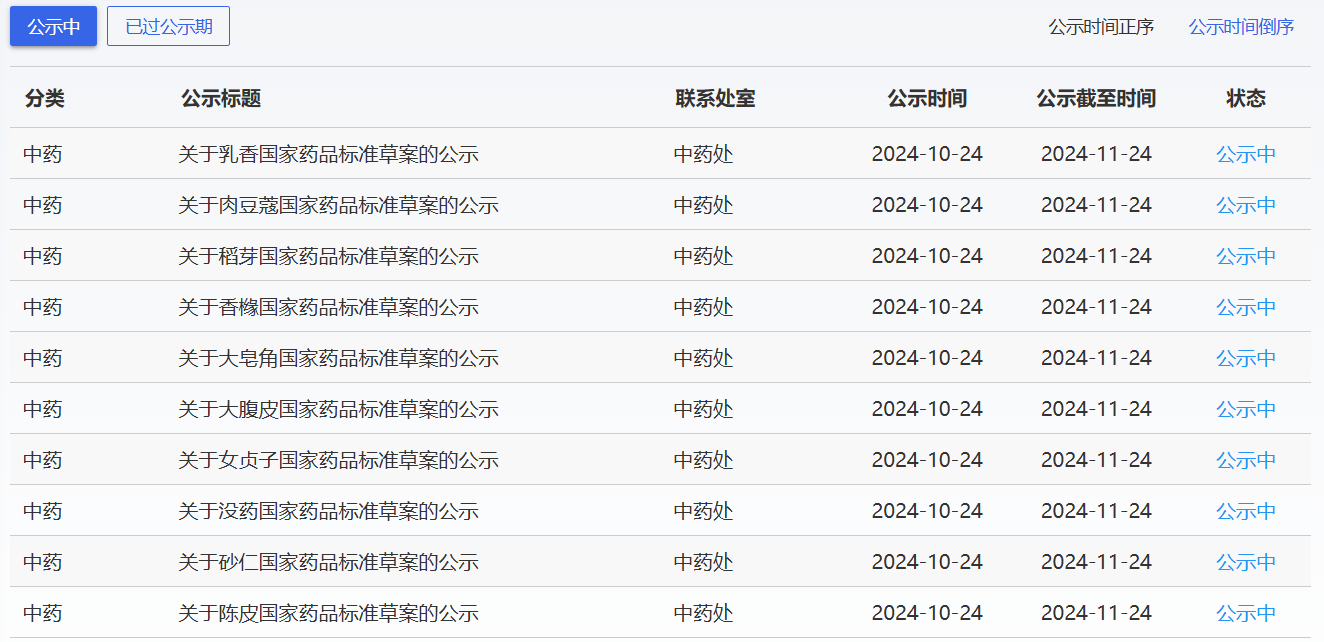
近期,藥典委發(fā)布的標(biāo)準(zhǔn)草案公示如下:
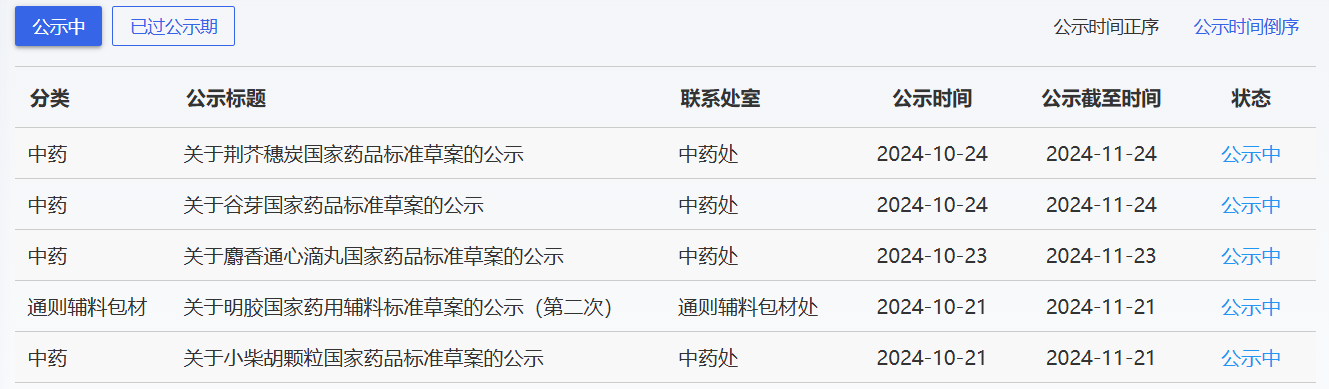
-END-


轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-61006450
Hotline服務(wù)熱線:010-61006450
 簡(jiǎn)體中文
簡(jiǎn)體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場(chǎng)部:
技術(shù)市場(chǎng)部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
