【干貨】細胞與基因治療全解析
過去30多年來, CGT領域抵住一個又一個時間節點的考驗逐步蛻變。從1990年代首項相關臨床試驗啟動,到2000年代因出現嚴重不良反應,整個領域遇冷,之后在人才、資本和政策的多重利好下,CGT重煥新生。數十款包括CAR-T療法、干細胞療法、溶瘤病毒療法和基因療法等在內的創新產品涌現,帶動了產業鏈上下游發展。
CGT定義及原理
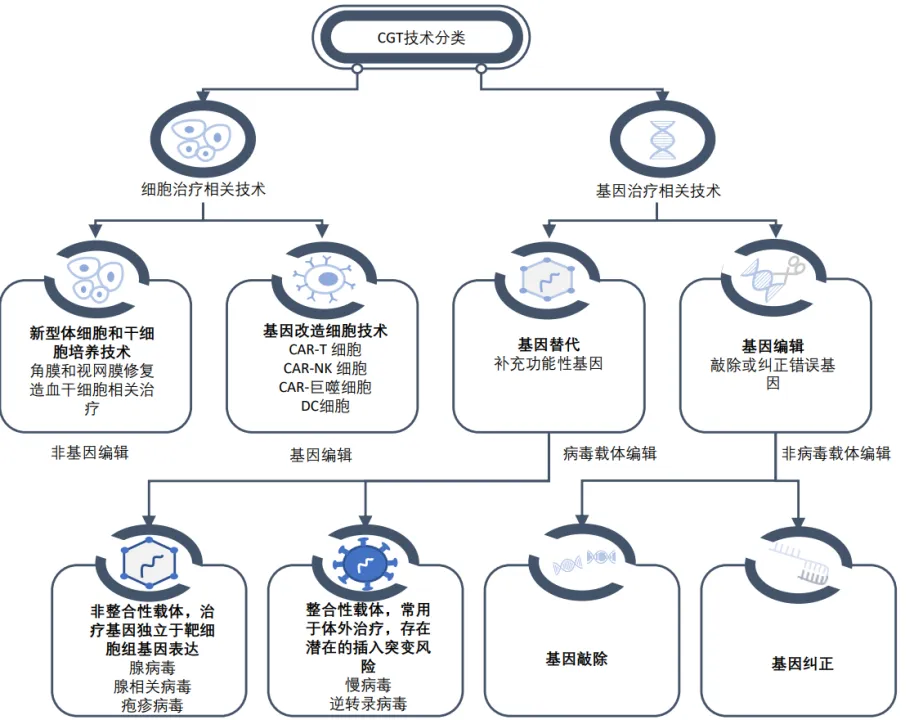
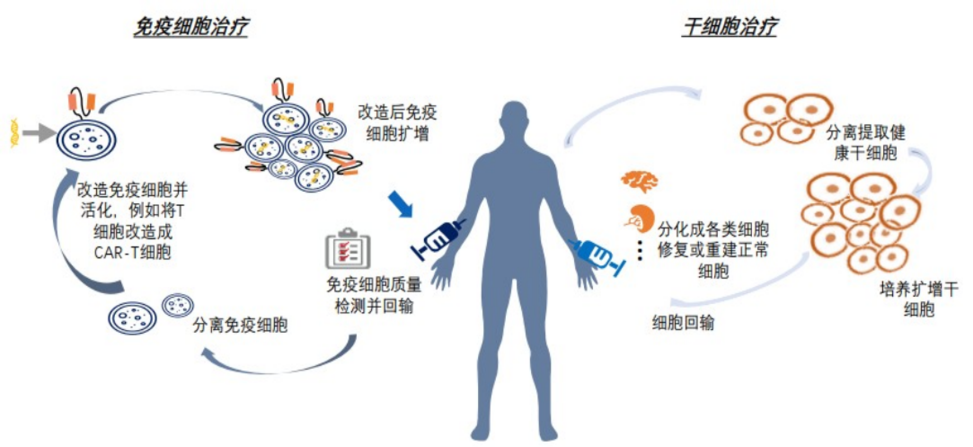
細胞治療是指應用人自體或異體來源的細胞經體外操作后輸入(或植入)人體,用于疾病治療的過程。體外操作包括但不限于分離、純化、培養、擴增、活化、細胞(系)的建立、凍存復蘇等。細胞治療主要可分為免疫細胞治療、干細胞治療和其它體細胞治療。
02 基因治療
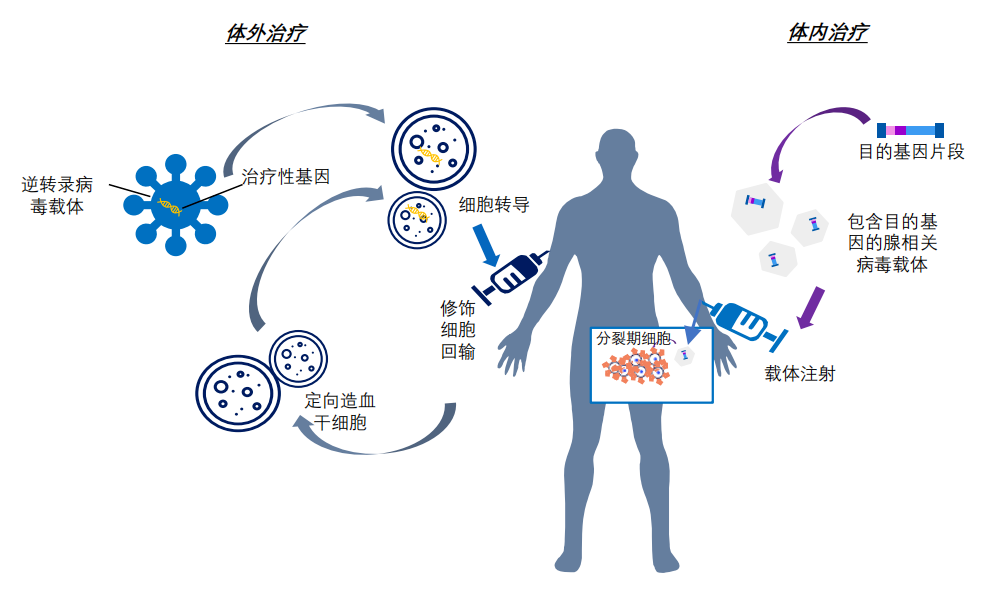
將外源正常基因導入到靶細胞內,校正或置換致病基因的一種療法。通過這種療法,目的基因或與宿主細胞染色體整合,或不整合位于染色體外,但能在細胞中得到表達,起到治療疾病的目的。
根據治療途徑,基因治療可分為體內基因治療和體外基因治療。其中體內基因治療是指將攜帶治療性基因的病毒或非病毒載體直接遞送到患者體內;體外基因治療則指將患者的細胞在體外進行遺傳修飾后回輸。
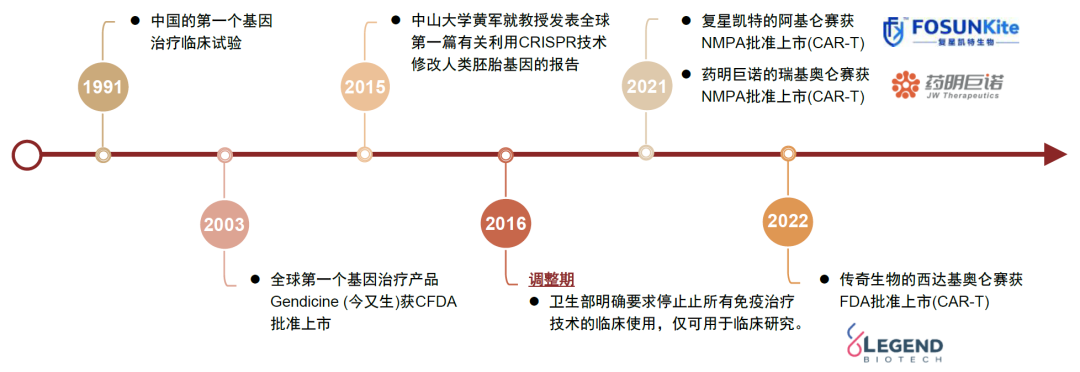
CGT發展歷程與趨勢
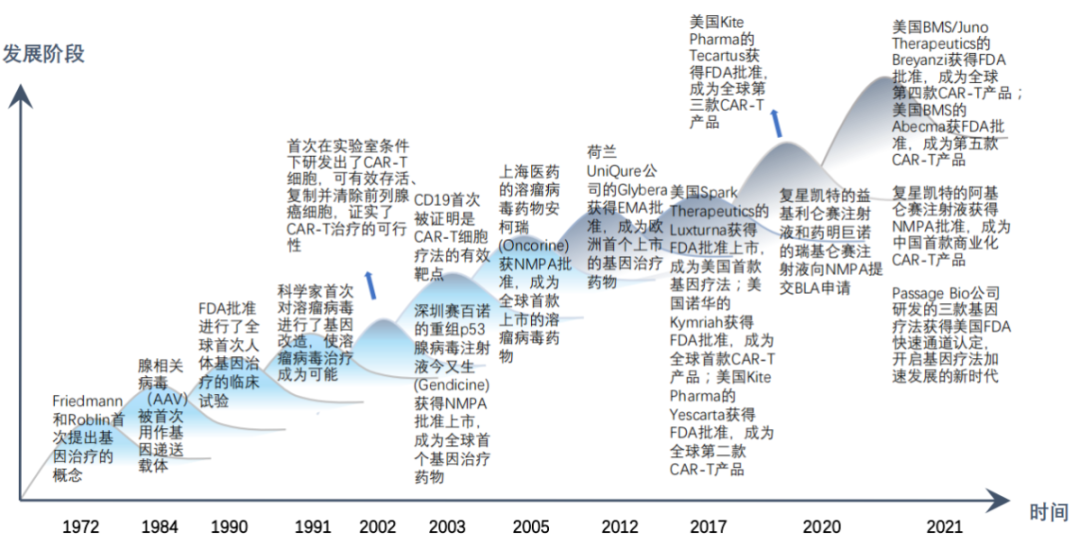
我國細胞與基因治療在20世紀90年代已有臨床研究,至2005年有兩款針對實體瘤的CGT產品,但是之后幾年熱度消散,直到2010年后細胞治療開始受到各大藥企及研發機構的青睞。2016年,魏則西事件一度導致一些細胞免疫管線研發進展滯后,然而隨著相關技術指導與監管體系的完善,CGT發展迅速,大量CGT產品進入臨床試驗,生物技術公司爭相布局CGT產業,復星凱特的阿基侖賽注射液于2021年6月獲得NMPA批準,成為中國首款上市的CAR-T產品。2022年傳奇生物的CAR-T產品西達基奧侖賽獲FDA批準上市。
據艾昆緯結合近年來基因和細胞療法發展現狀和趨勢做的總結報告中指出,截至2023年底,全球共獲批上市76款基因和細胞療法的藥物。在過去3年中,有20款療法獲批上市,其中,CAR-T療法和其它基于細胞的癌癥免疫療法在過去10年中進展迅速,截至2023年底全球已有12款療法獲批;另外還有19款基因療法在全球范圍內獲批,主要用于遺傳病的治療。
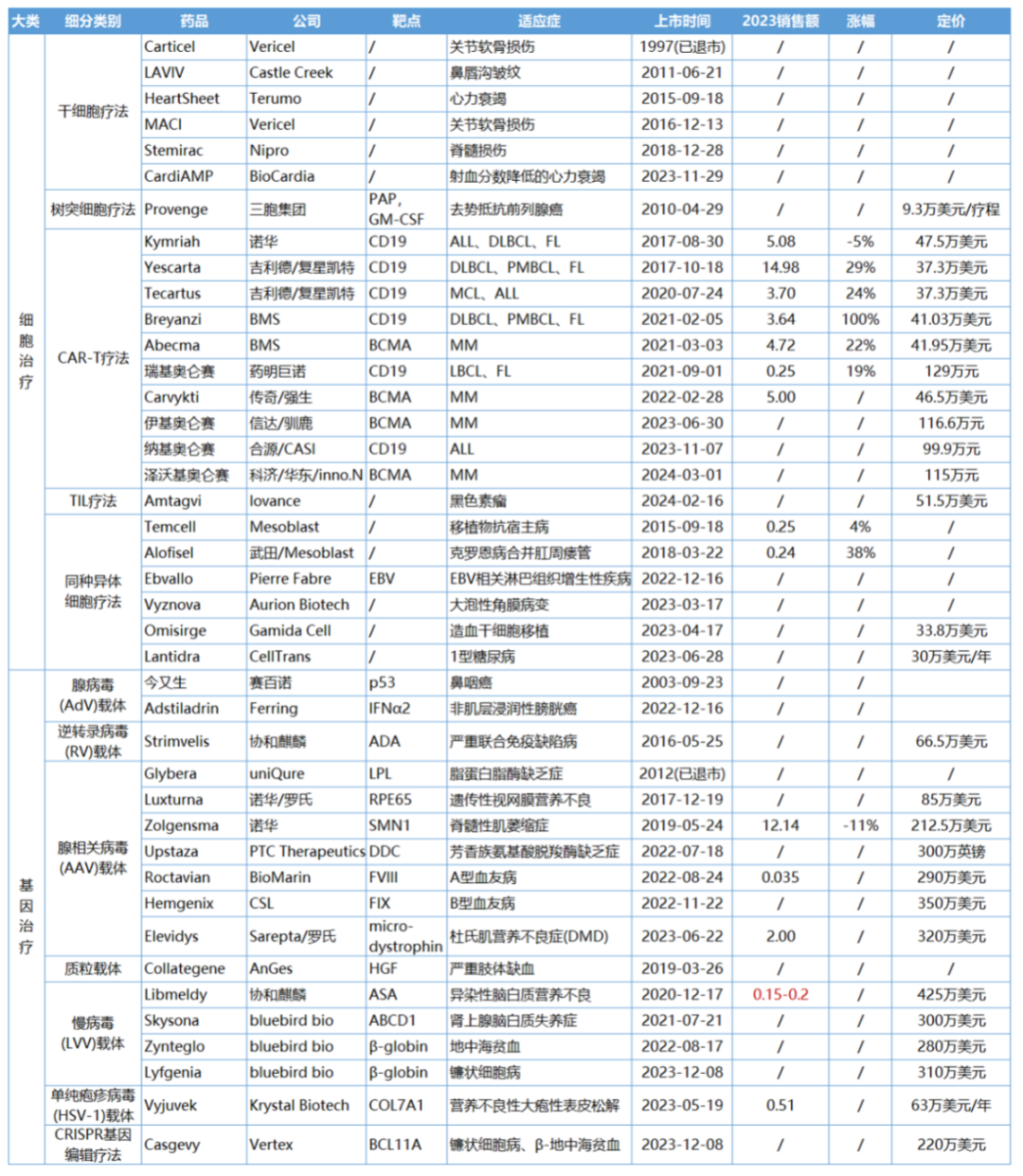
下圖主要統計了在美國、日本、歐盟和中國獲批上市的41款CGT產品,其中有24款屬于細胞療法,17款為基因療法。
目前,全球已有900多家公司專注于CGT療法的研究,同時有1000多項臨床試驗正在進行中。預計從2025年開始,每年可能有多達10到20種新的先進療法獲得批準。此外,歐洲在CGT領域的臨床試驗中占據了重要位置,占比達到33%。全球生物制藥公司以及眾多風險投資初創公司正迅速投資這一充滿潛力的領域。
自2018年以來,全球在細胞、基因和基因修飾療法等先進療法上的投資已達到約130億美元。而在2019年,與CGT相關的并購交易總額更是超過了1560億美元。
然而,與任何創新和顛覆性技術一樣,CGT開發人員也面臨著諸多挑戰。在產品生命周期的關鍵階段,如患者可及性、供應鏈管理、產品制造、滿足日益復雜的監管要求以及探索新的商業模式等方面,都需要克服重重困難。盡管如此,隨著技術的不斷進步和市場的持續擴大,我們有理由相信,細胞和基因治療將在未來為更多患者帶來福音。

5月17-19日,第十六屆國際藥物信息大會/2024DIA蘇州年會暨展覽會在蘇州舉辦。屆時,新領先CXO·深藍海將在 CM21 展位設展,歡迎前來交流咨詢!
-END-
轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
