一文了解特醫(yī)食品!(附申報(bào)流程)
特醫(yī)食品分類
特殊醫(yī)學(xué)用途配方食品分為供1歲以下嬰兒食用的特殊醫(yī)學(xué)用途嬰兒配方食品和供1歲以上人群食用的特殊醫(yī)學(xué)用途配方食品。適用于1歲以上人群的特醫(yī)食品又分為全營養(yǎng)配方食品、特定全營養(yǎng)配方食品和非全營養(yǎng)配方食品。

01 全營養(yǎng)配方食品
(高能量)高蛋白,維生素、礦物質(zhì)等營養(yǎng)素齊全,可作為單一營養(yǎng)來源,適用于需對營養(yǎng)素進(jìn)行全面補(bǔ)充且對特定營養(yǎng)素沒有特別要求的人群,如重大疾病的恢復(fù)期、重大手術(shù)及創(chuàng)傷的營養(yǎng)支持、老年人日常營養(yǎng)補(bǔ)充等。
具有特殊性質(zhì)的,可作為單一營養(yǎng)來源來滿足目標(biāo)人群在特定疾病或醫(yī)學(xué)狀況下營養(yǎng)需求的特殊醫(yī)學(xué)用途配方食品。
可滿足目標(biāo)人群部分營養(yǎng)需求,適用于需要補(bǔ)充單一或部分營養(yǎng)素的人群,不能作為單一營養(yǎng)來源。
特醫(yī)食品法規(guī)標(biāo)準(zhǔn)
特醫(yī)食品作為一種為患者或特殊營養(yǎng)醫(yī)學(xué)狀況人群提供營養(yǎng)支持的食品,在國外已經(jīng)有很長的使用歷史,并且取得了很好的臨床效果。很多國際組織和發(fā)達(dá)國家都有針對性地制定了相應(yīng)的管理政策和法律法規(guī)。
目前世界上很多國家和地區(qū)都制定了特殊醫(yī)學(xué)用途配方食品的標(biāo)準(zhǔn)和法規(guī),如國際食品法典委員會(CAC)、歐盟、美國、澳大利亞、新西蘭、日本等。

我國特醫(yī)食品發(fā)展起步較晚,隨著進(jìn)口配方食品,尤其是嬰幼兒配方食品和功能性的配方食品源源不斷的進(jìn)入中國市場,我國才逐步開啟了對特醫(yī)食品的關(guān)注之路。
2016年3月10日,國家食品藥品監(jiān)督管理總局正式公布了《特殊醫(yī)學(xué)用途配方食品注冊管理方法》,并于同日發(fā)布了“《特殊醫(yī)學(xué)用途配方食品注冊管理辦法》解讀”,自此,我國嚴(yán)格管控特醫(yī)食品注冊審查,明確不同類別產(chǎn)品審評技術(shù)要求和原輔料標(biāo)準(zhǔn)要求,特醫(yī)食品的生產(chǎn)及應(yīng)用步入了發(fā)展期,產(chǎn)業(yè)迎來了高速發(fā)展。
國家市場監(jiān)督管理總局SAMR食品審評機(jī)構(gòu)承擔(dān)特殊醫(yī)學(xué)用途配方食品注冊申請的受理、審評等工作。可登錄網(wǎng)站進(jìn)行線上注冊申報(bào)。網(wǎng)址:https://tyspzc.gsxt.gov.cn/stzcww/login/loginAction!login.dhtml

小編為大家詳細(xì)梳理了申報(bào)流程圖,收藏保存哦!
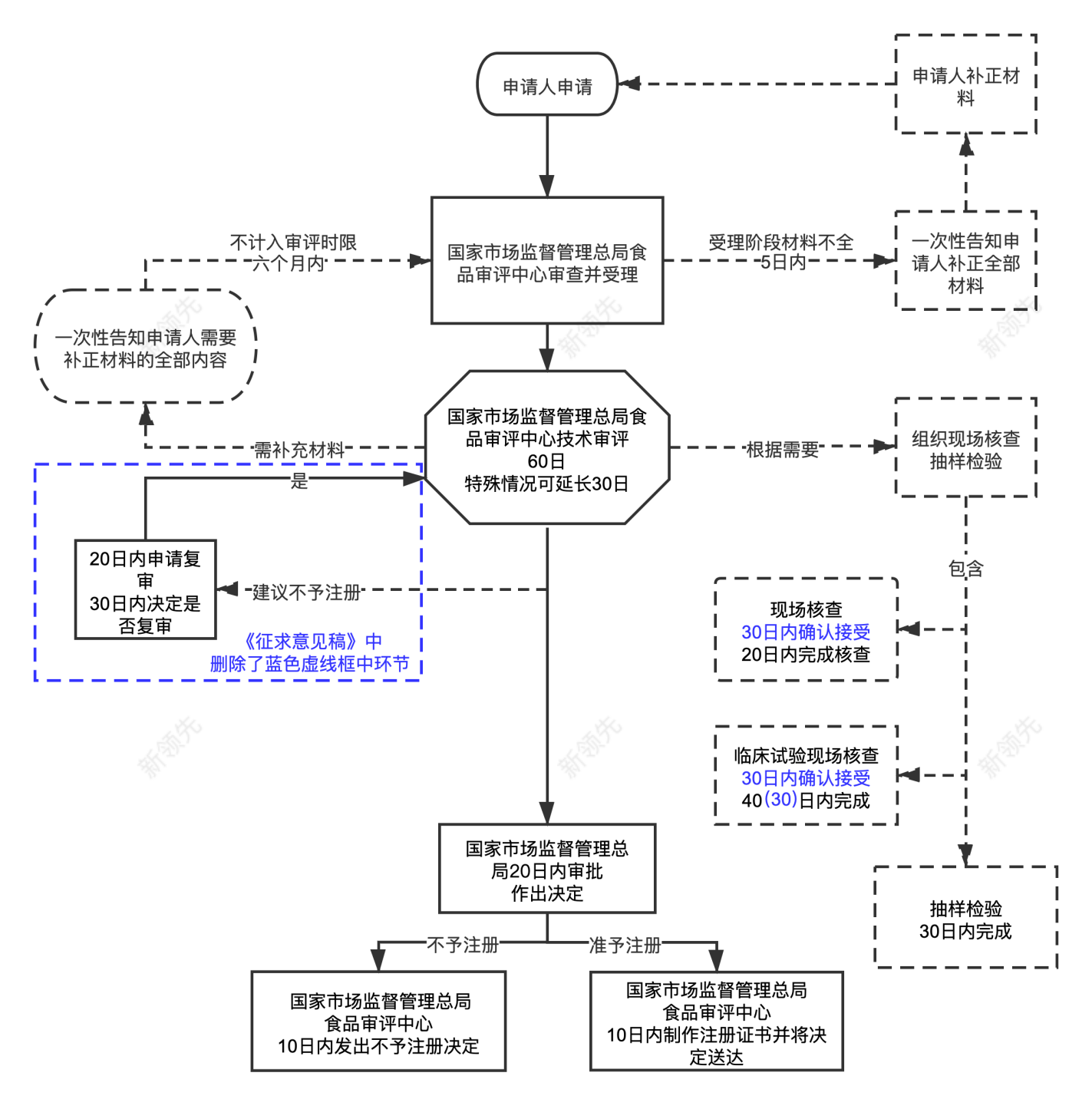
另外,在2023年11月28日國家市場監(jiān)督管理總局發(fā)布了《特殊醫(yī)學(xué)用途配方食品注冊管理辦法》中,明確規(guī)定 ①罕見病類特殊醫(yī)學(xué)用途配方食品;②臨床急需且尚未批準(zhǔn)過的新類型特殊醫(yī)學(xué)用途配方食品;③國家市場監(jiān)督管理總局規(guī)定的其他優(yōu)先審評審批的情形可以納入優(yōu)先審評審批程序。
特醫(yī)食品市場現(xiàn)狀
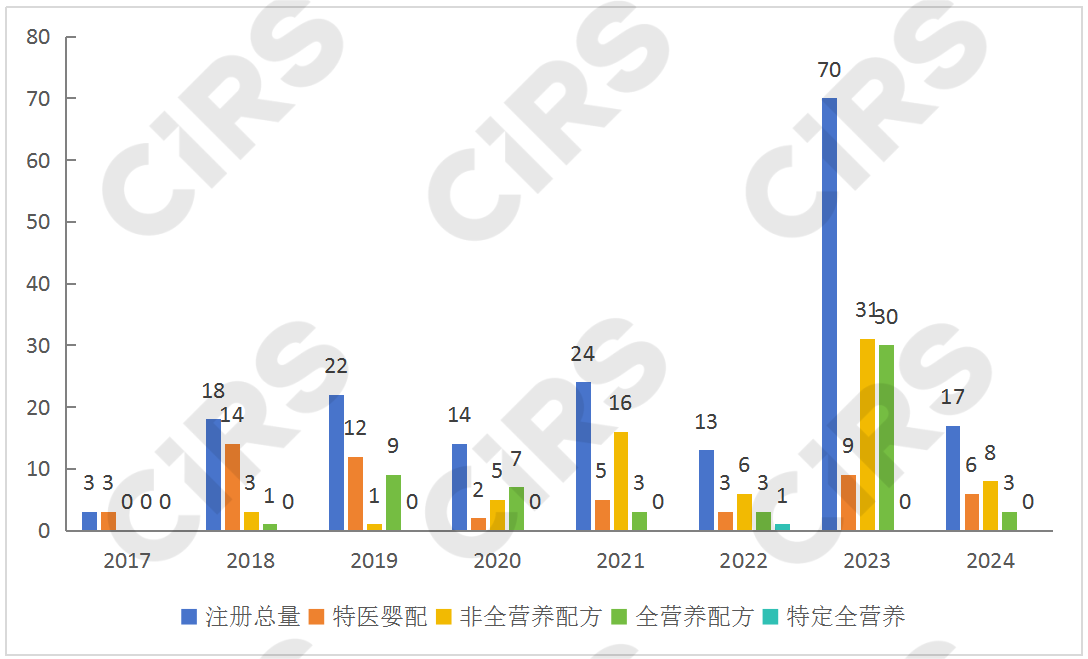
自2017年第一款特醫(yī)嬰配產(chǎn)品注冊成功后,特醫(yī)食品注冊大門正式打開。下圖可知,特醫(yī)嬰配呈現(xiàn)高開低走的趨勢,其注冊主要集中于2018年和2019年,非全營養(yǎng)配方的注冊則集中于2021和2023年。2022年總注冊量較少,但注冊產(chǎn)品類型增多,且新增了首款特定全營養(yǎng)配方食品。2023年新增了首款增稠組件,注冊類型主要集中于全營養(yǎng)和非全營養(yǎng)產(chǎn)品,其占比高達(dá)87%。相比2022年注冊量,2023年呈現(xiàn)爆發(fā)式增長。2024年第一季度已新增17款產(chǎn)品,由此可見2024年的產(chǎn)品獲批勢頭強(qiáng)勁,而特定全營養(yǎng)食品依然是需要繼續(xù)突破的大關(guān)。
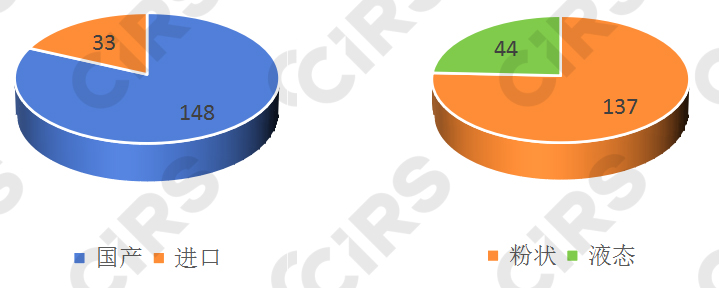
截至2024年4月1日,共計(jì)181款特醫(yī)食品注冊獲批,國產(chǎn)148款,進(jìn)口33款,國產(chǎn)產(chǎn)品注冊數(shù)量已遠(yuǎn)超進(jìn)口產(chǎn)品。在已批準(zhǔn)的181款產(chǎn)品中,粉狀產(chǎn)品居多,有137款產(chǎn)品的劑型為粉狀,其余44款為液態(tài)產(chǎn)品。
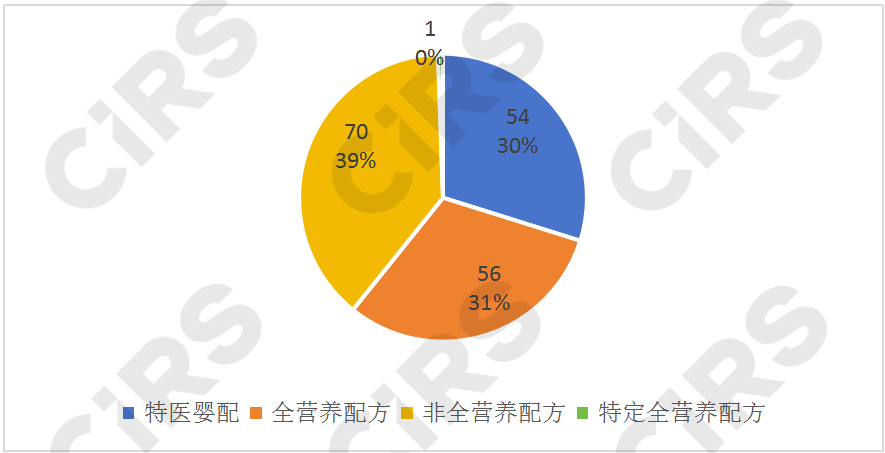
01 特醫(yī)食品產(chǎn)品類型
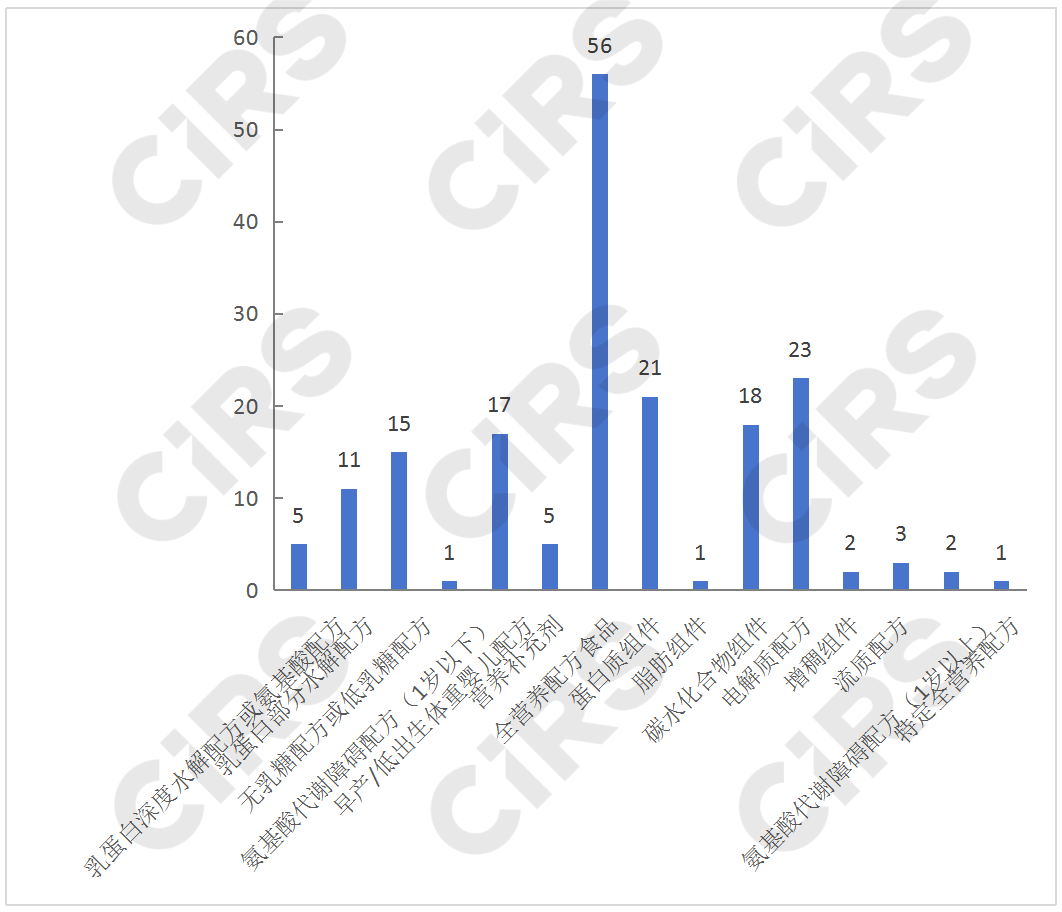
目前,已獲批產(chǎn)品中有54款為特殊醫(yī)學(xué)用途嬰兒配方食品,占到了總數(shù)的30%,包括5款乳蛋白深度水解配方或氨基酸配方、11款乳蛋白部分水解配方、15款無乳糖或低乳糖配方、1款氨基酸代謝障礙配方、17款早產(chǎn)/低出生體重嬰兒配方、5款營養(yǎng)補(bǔ)充劑;70款為非全營養(yǎng)配方食品,包括21款蛋白質(zhì)組件、1款脂肪組件、18款碳水化合物組件、23款電解質(zhì)配方、2款增稠組件、3款流質(zhì)配方、2款氨基酸代謝障礙配方(1歲以上),占總數(shù)的39%;56款為全營養(yǎng)配方食品,占總數(shù)的32%,包括9款全營養(yǎng)配方食品(1-10歲)和47款全營養(yǎng)配方食品(1歲以上);特定全營養(yǎng)配方食品僅有1款,為速熠素特殊醫(yī)學(xué)用途腫瘤全營養(yǎng)配方食品。
02 特醫(yī)食品注冊企業(yè)
目前共有52家企業(yè)獲得特醫(yī)食品注冊,國內(nèi)獲得注冊證書的企業(yè)達(dá)到44家,雀巢仍以共計(jì)15款產(chǎn)品成為在華獲批產(chǎn)品數(shù)量最多的企業(yè),吉林麥孚位列第二。雀巢、雅培、紐迪希亞作為全球領(lǐng)先級的特醫(yī)食品企業(yè),在非嬰兒特醫(yī)食品和嬰兒特醫(yī)食品領(lǐng)域均有產(chǎn)品獲批。
而境內(nèi)企業(yè)存在產(chǎn)品單一化現(xiàn)象,如國內(nèi)藥企主要集中于非嬰兒特醫(yī)食品領(lǐng)域,國內(nèi)乳品企業(yè)主要集中于嬰兒特醫(yī)食品領(lǐng)域,僅部分營養(yǎng)企業(yè)同時(shí)涉足嬰兒特醫(yī)食品和非嬰兒特醫(yī)食品。從注冊企業(yè)和產(chǎn)品數(shù)量來看,境內(nèi)注冊企業(yè)和產(chǎn)品持續(xù)增多,早已遠(yuǎn)超境外企業(yè)并占據(jù)了主導(dǎo)地位。目前特醫(yī)食品的注冊主要集中于乳品、營養(yǎng)健康、制藥等企業(yè)。
我國人民群眾對于個(gè)人健康的重視程度不斷增加,對于營養(yǎng)與疾病認(rèn)知的不斷深入,促使特醫(yī)食品的普及和應(yīng)用迎來嶄新的發(fā)展機(jī)遇。為可靠保障特殊疾病狀態(tài)人群的生命安全和身體健康特醫(yī)食品的嚴(yán)格化、規(guī)范化、保障化也成為我國食品監(jiān)管體系的重中之重。
特醫(yī)食品的注冊申報(bào)資料要求等,詳見《收藏 | 特醫(yī)食品注冊申報(bào)的那些事》!

-END-


轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-61006450
Hotline服務(wù)熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場部:
技術(shù)市場部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
