政策法規(guī) || 《罕見病基因治療產(chǎn)品臨床試驗(yàn)技術(shù)指導(dǎo)原則》(附法規(guī)概覽01.15-01.19)
01
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《間充質(zhì)干細(xì)胞防治移植物抗宿主病臨床試驗(yàn)技術(shù)指導(dǎo)原則》《罕見病基因治療產(chǎn)品臨床試驗(yàn)技術(shù)指導(dǎo)原則》的通告(2024年第7號(hào))
 掃描識(shí)別圖中二維碼
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

01
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《治療用重組蛋白產(chǎn)品臨床試驗(yàn)申請(qǐng)病毒清除工藝平臺(tái)驗(yàn)證技術(shù)指導(dǎo)原則(試行)》的通告(2024年第2號(hào))
 掃描識(shí)別圖中二維碼
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

02
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《抗腫瘤藥物說明書安全性信息撰寫技術(shù)指導(dǎo)原則》的通告(2024年第3號(hào))
 掃描識(shí)別圖中二維碼
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

03
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《放射性標(biāo)記人體物質(zhì)平衡研究技術(shù)指導(dǎo)原則》的通告(2024年第4號(hào))
 掃描識(shí)別圖中二維碼
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

04
關(guān)于公開征求《化學(xué)仿制藥參比制劑目錄(第七十八批)》(征求意見稿)意見的通知
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

05
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《藥物免疫毒性非臨床研究技術(shù)指導(dǎo)原則》的通告(2024年第5號(hào))
 掃描識(shí)別圖中二維碼
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

06
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《人源干細(xì)胞產(chǎn)品非臨床研究技術(shù)指導(dǎo)原則》的通告(2024年第6號(hào))指導(dǎo)原則》的通告(2024年第5號(hào))
 掃描識(shí)別圖中二維碼
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

01
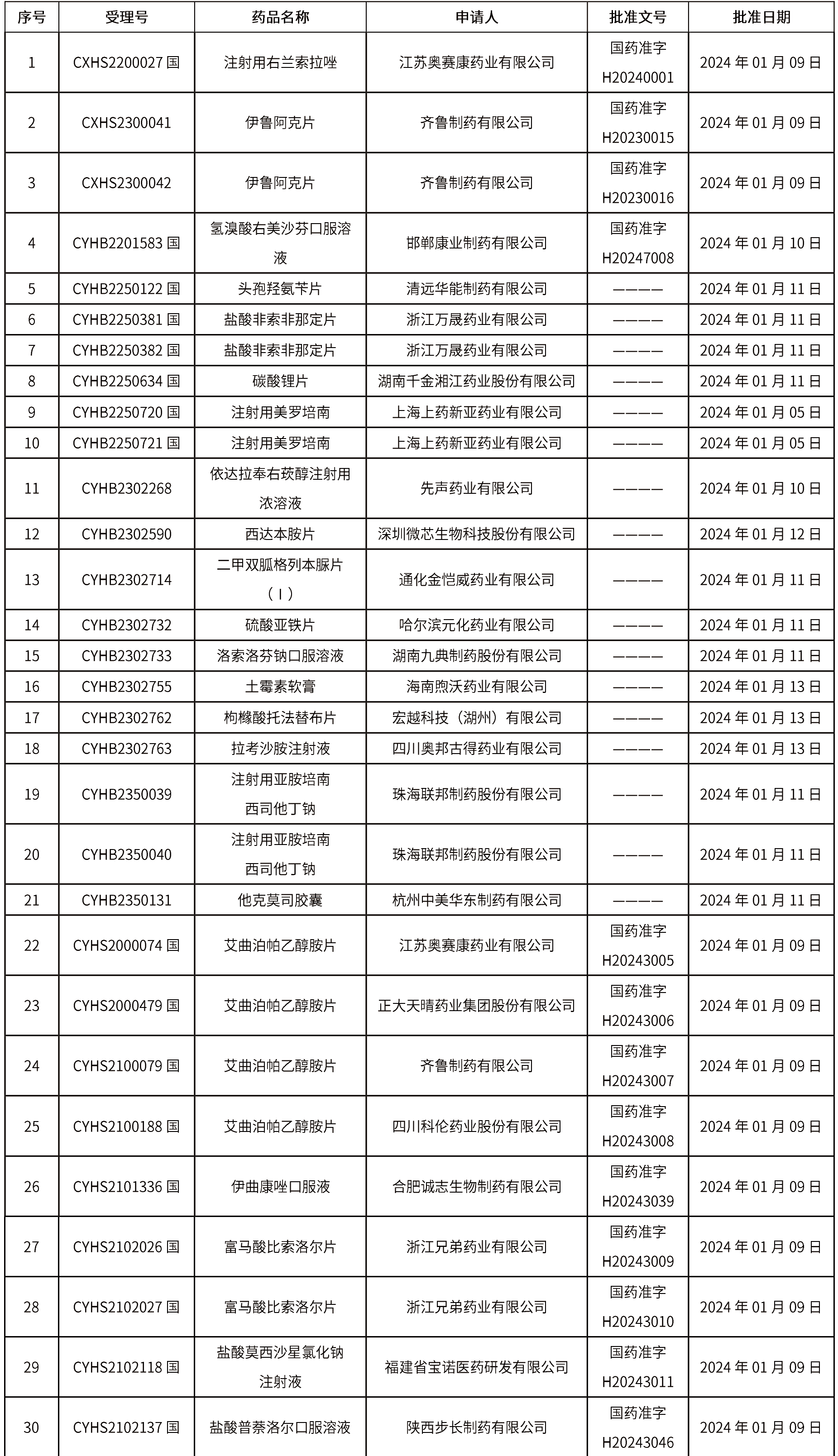
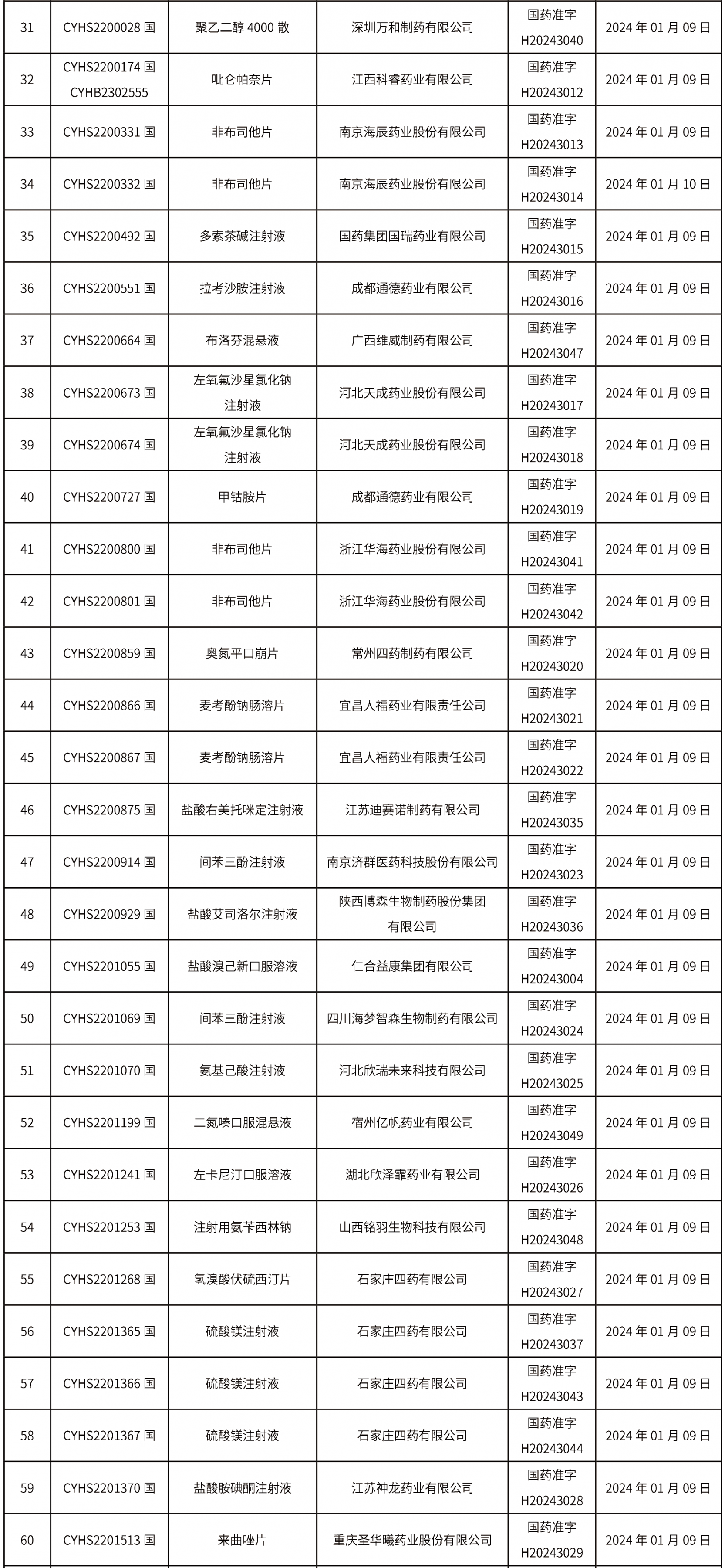
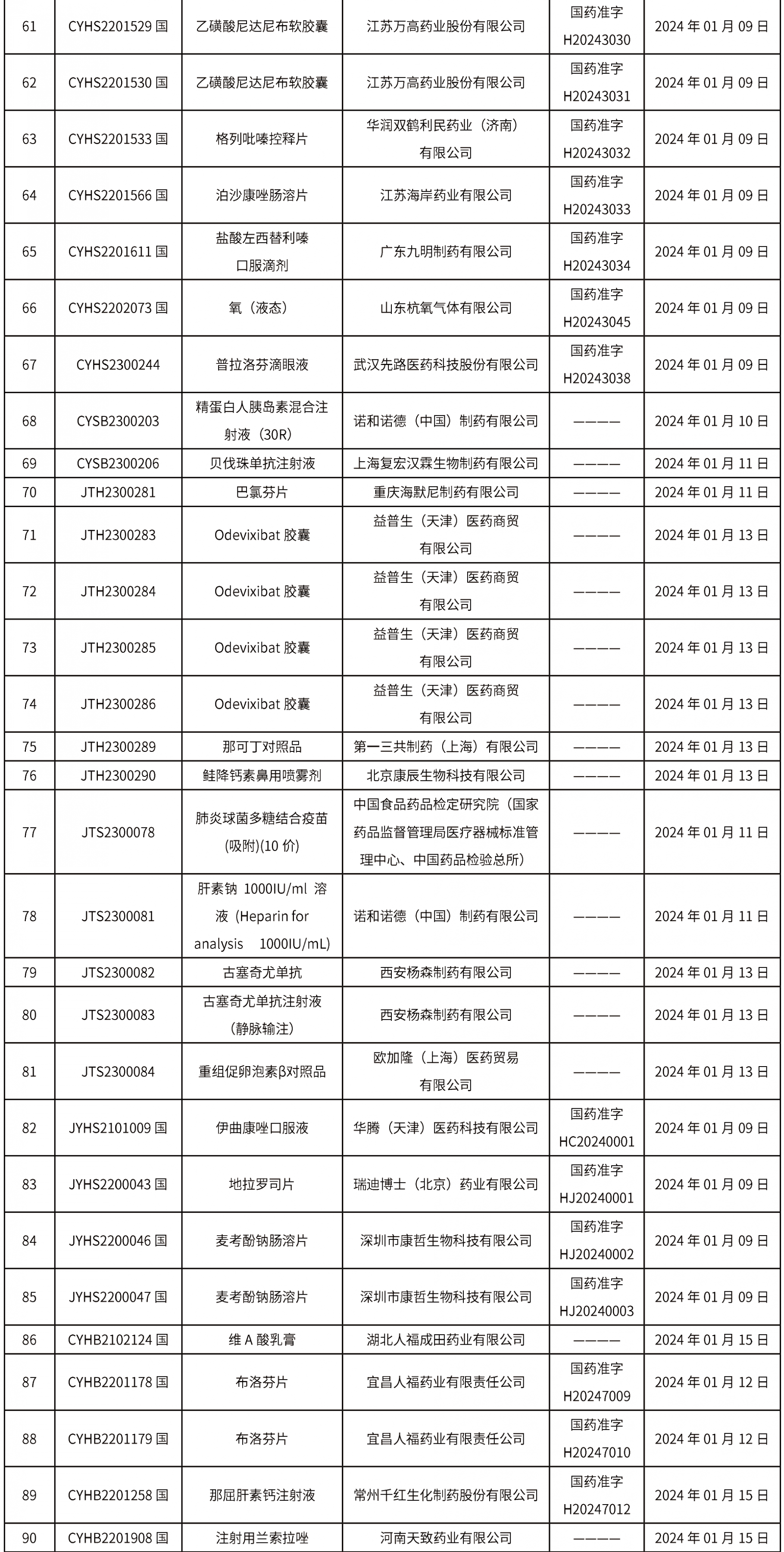
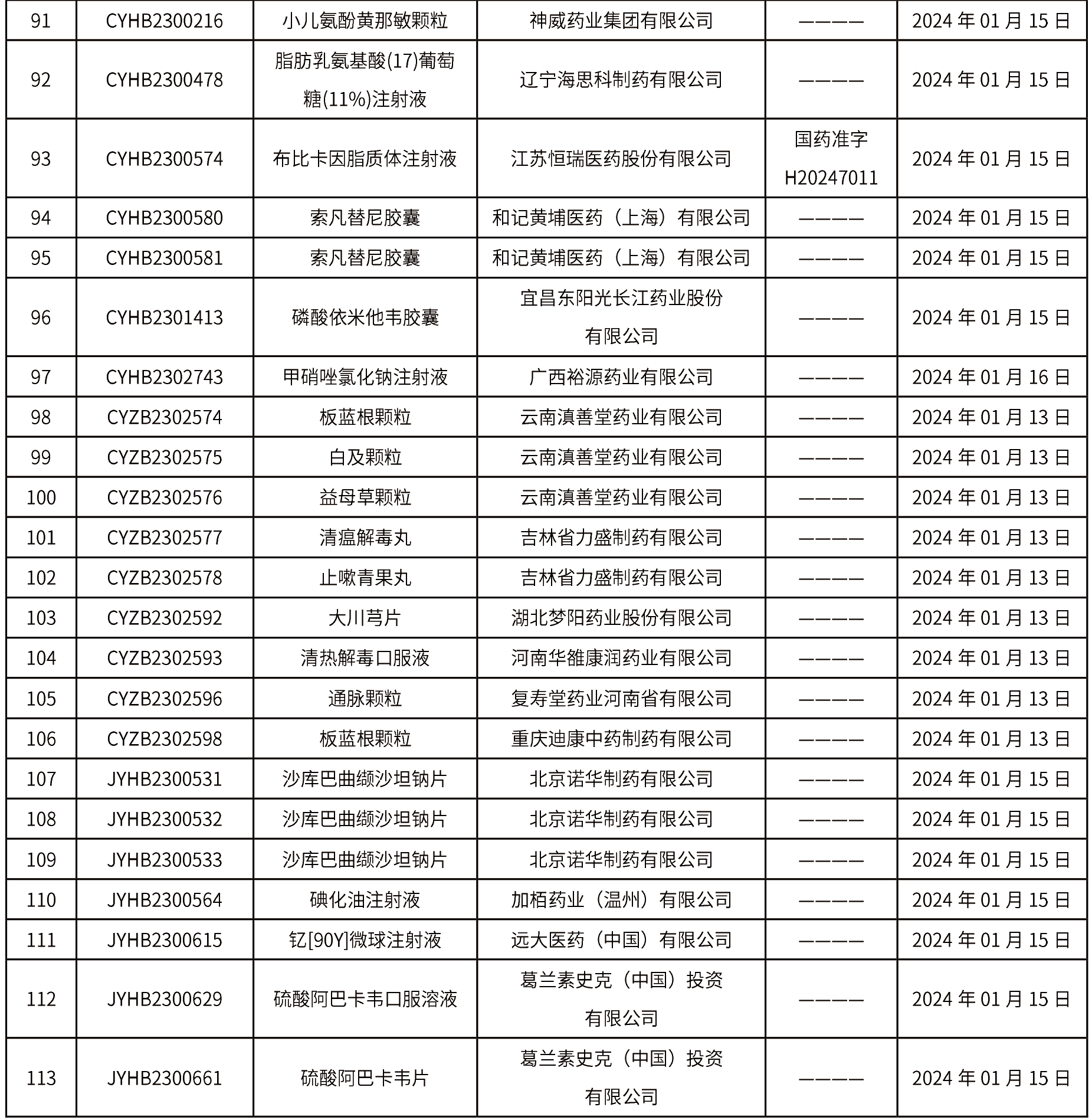
本周(截止到1月19日14:00)共發(fā)布藥品批準(zhǔn)證明文件送達(dá)信息113個(gè),其中一致性評(píng)價(jià)9個(gè),注射劑32個(gè)。
02
2024年1月15日中藥品種保護(hù)受理公示
 掃描識(shí)別圖中二維碼
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

非處方藥轉(zhuǎn)換固腎合劑的公示
 掃描識(shí)別圖中二維碼
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

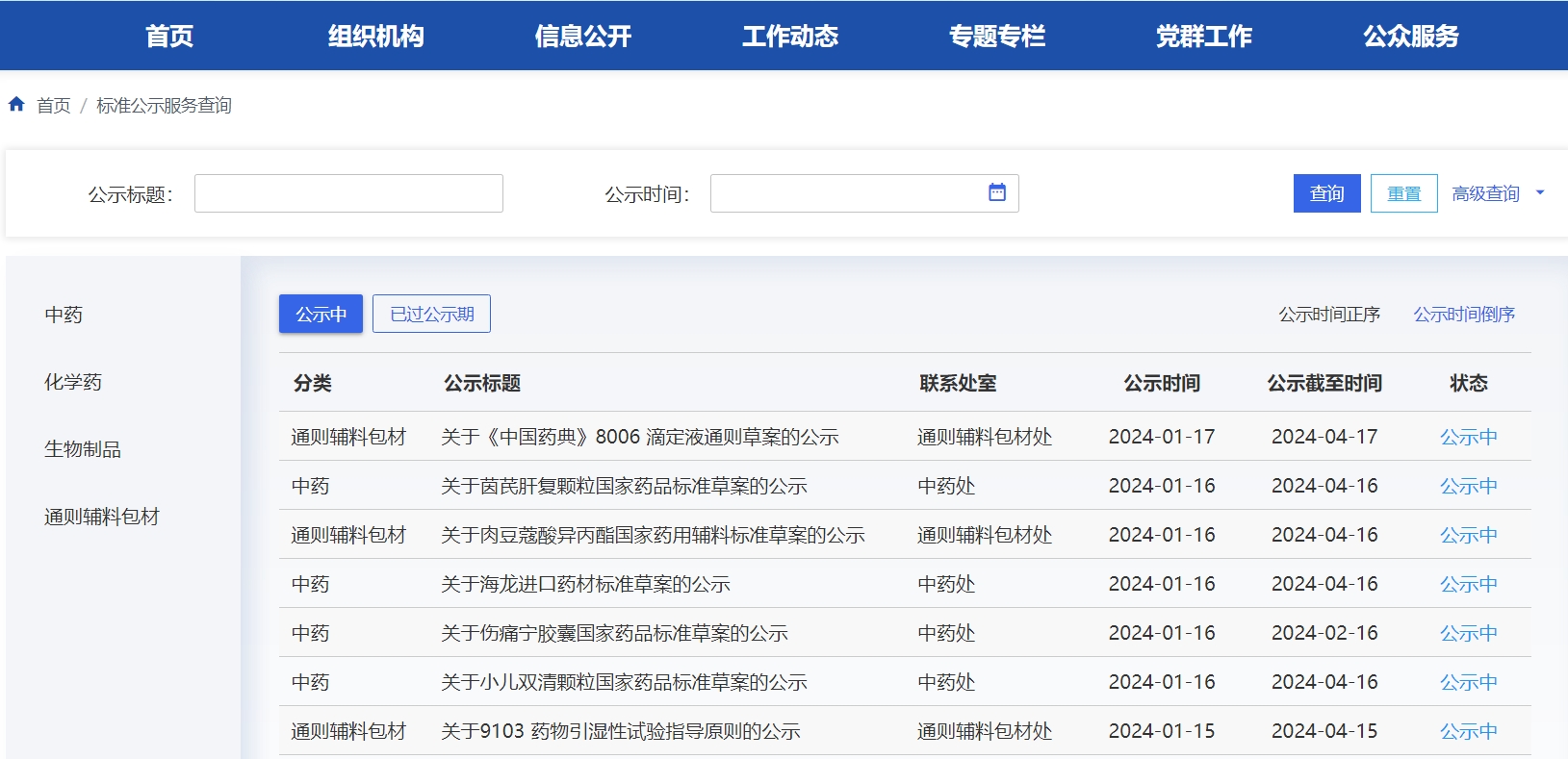
本周藥典委發(fā)布4個(gè)品種國(guó)家藥品、肉豆蔻酸異丙酯國(guó)家藥用輔料、《中國(guó)藥典》8006 滴定液通則、9103 藥物引濕性試驗(yàn)指導(dǎo)原則的公示。
 掃描識(shí)別圖中二維碼
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

-END-


轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-61006450
Hotline服務(wù)熱線:010-61006450
 簡(jiǎn)體中文
簡(jiǎn)體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場(chǎng)部:
技術(shù)市場(chǎng)部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
