【全】各國匯總 | 局部外用制劑質(zhì)量評價的法規(guī)要求
局部外用制劑具有可直接作用于患處發(fā)揮藥效、避免藥物的肝首過效應(yīng)等優(yōu)點(diǎn)。但由于皮膚屏障的存在,藥物通過皮膚角質(zhì)層較為困難,導(dǎo)致起效慢,且很多藥物無法達(dá)到有效治療濃度,因此藥物釋放量及經(jīng)皮滲透量的研究至關(guān)重要。本文匯總分析了國內(nèi)外對局部外用制劑仿制藥的質(zhì)量一致性評價要求,以指導(dǎo)藥物開發(fā)。
「局部外用制劑仿制藥的一致性評價要求 」
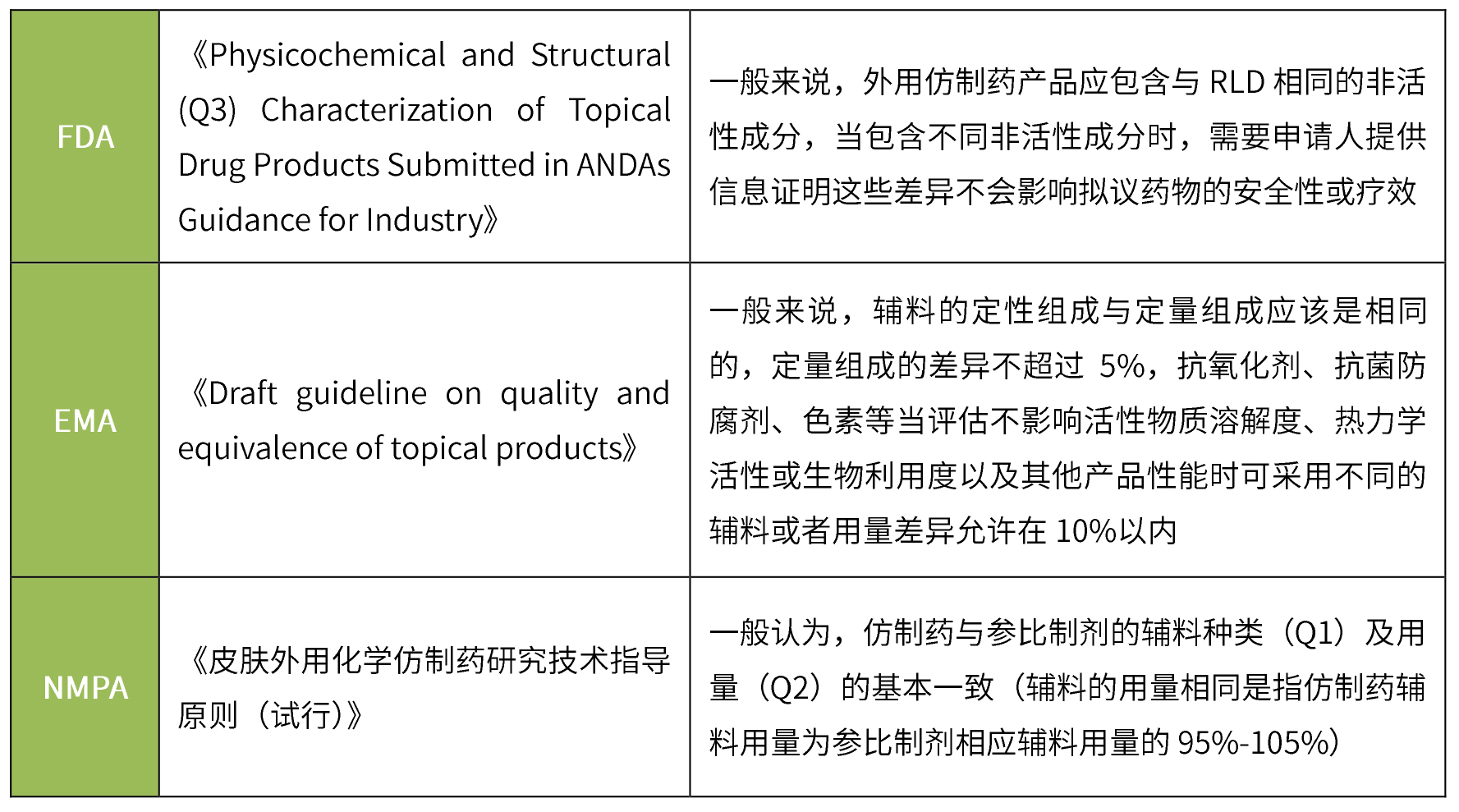
透皮制劑仿制藥一般要求與參比制劑的輔料種類及用量一致,無論FDA、EMA還是NMPA,在對處方組成的要求上大同小異,均要求輔料種類一致、用量基本相同。
根據(jù)《皮膚外用化學(xué)仿制藥研究技術(shù)指導(dǎo)原則(試行)》及《新注冊分類的皮膚外用仿制藥的技術(shù)評價要求(征求意見稿)》:
-
軟膏劑、凝膠劑在開發(fā)過程中需注意對原料藥預(yù)處理工藝(如微粉化處理)、加入方式及分散手段等進(jìn)行研究,以保證仿制藥與參比制劑中藥物晶型、粒度及粒度分布、含量均勻性等關(guān)鍵質(zhì)量指標(biāo)的一致。
-
乳膏劑、乳劑需對物料加入的順序、溶解溫度、乳化、剪切速度及混合時間等關(guān)鍵工藝參數(shù)進(jìn)行研究,以保證與參比制劑的質(zhì)量一致性。
3、質(zhì)量控制
根據(jù)《Physicochemical and Structural (Q3) Characterization of Topical Drug Products Submitted in ANDAs Guidance for Industry》:通常建議申請人對照參比制劑對其申請的仿制藥進(jìn)行Q3特性比較,并提供可接受的體外釋放試驗(yàn)(IVRT)和體外滲透試驗(yàn)(IVPT)的證明。其中基本Q3表征通常包括:
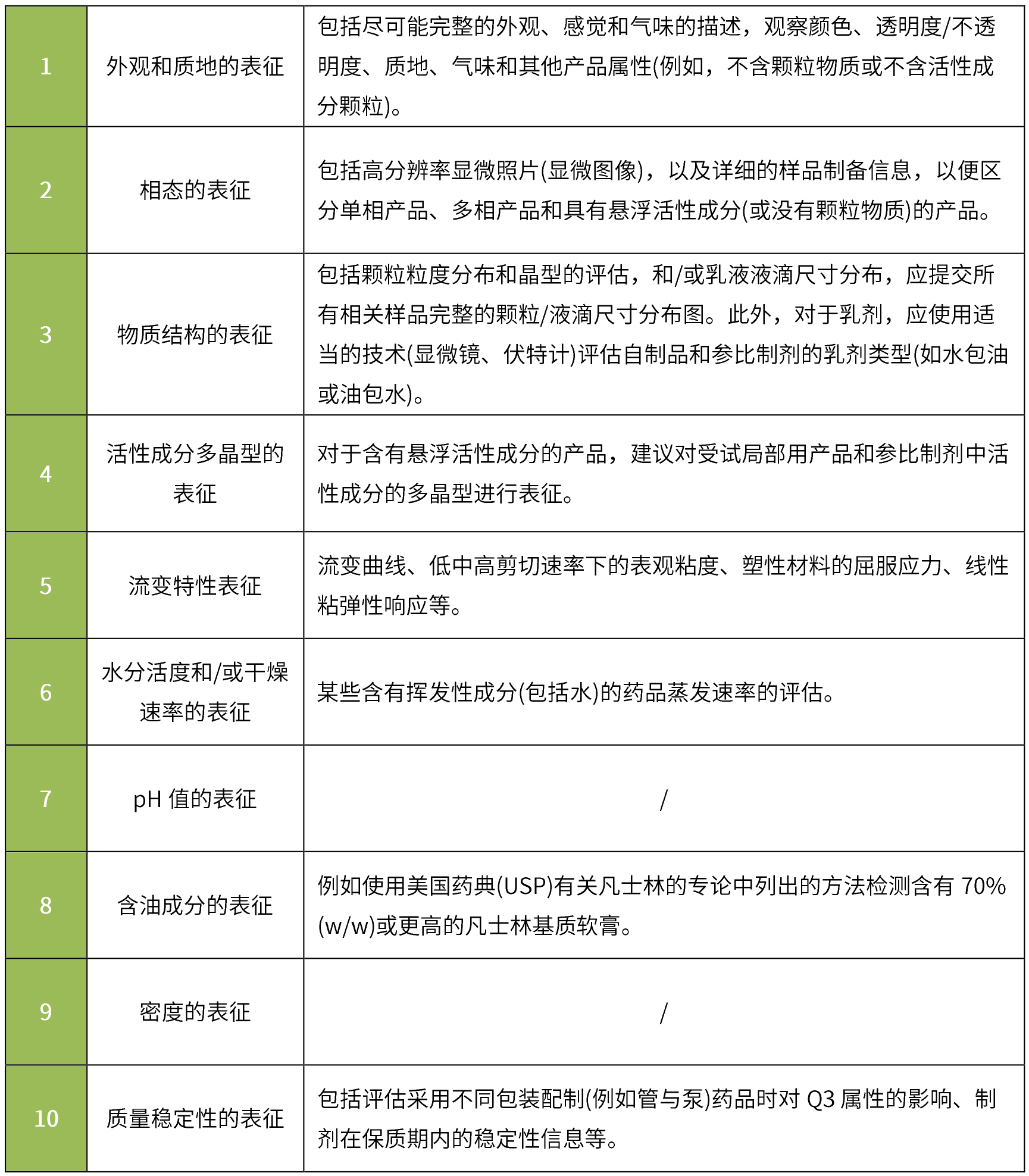
Q3相同/相似標(biāo)準(zhǔn):在多個批次中表征的每個相關(guān)Q3屬性在參比制劑的Q3屬性表征范圍內(nèi),或在由官方機(jī)構(gòu)確定的可接受變化范圍。
要求與參比制劑進(jìn)行質(zhì)量數(shù)據(jù)的比較,應(yīng)比較劑型(單相/兩相、油包水型/水包油型等)、處方組成的定性和定量、微觀結(jié)構(gòu)/物理性質(zhì)(pH值、粘度、密度、表面張力、滲透壓、流變特性等)、產(chǎn)品性能(體外釋放試驗(yàn)、藥物在皮膚和作用部位的擴(kuò)散等)。
產(chǎn)品質(zhì)量等效的對比應(yīng)在能代表上市產(chǎn)品和生產(chǎn)過程的批次上進(jìn)行,即達(dá)到或接近生產(chǎn)規(guī)模的批次。如果制造工藝和設(shè)備沒有變化,并且提供的證據(jù)表明放大不影響產(chǎn)品質(zhì)量,則可用至少 1/10 生產(chǎn)規(guī)模的中試批次來表征和比較,至少應(yīng)比較三個不同批次的測試產(chǎn)品和參比制劑,為了能夠進(jìn)行統(tǒng)計(jì)評估,每個實(shí)驗(yàn)的樣本數(shù)量至少應(yīng)為每批12個單位。
對于定量質(zhì)量特性,假設(shè)數(shù)據(jù)呈正態(tài)分布,測試產(chǎn)品和比較產(chǎn)品均值差異的90%置信區(qū)間應(yīng)包含在參比制劑均值的+/- 10%的驗(yàn)收標(biāo)準(zhǔn)內(nèi)。
皮膚外用制劑的關(guān)鍵質(zhì)量屬性一般包括但不限于以下項(xiàng)目:外觀、混懸藥物的晶型、粒度分布、液滴粒徑、流變特性、pH值、黏度、含量均勻度、微生物限度、有關(guān)物質(zhì)、抑菌劑含量及抗氧劑含量、無菌(用于燒傷(除輕度 I°或 II°外)或嚴(yán)重創(chuàng)傷的無菌制劑)以及體外釋放試驗(yàn)(IVRT)和體外透皮試驗(yàn)(IVPT)等。
應(yīng)對仿制品與參比制劑進(jìn)行全面的質(zhì)量對比研究,并提供體外釋放對比試驗(yàn)和體外透皮對比試驗(yàn)數(shù)據(jù),以證明二者質(zhì)量的一致性,原則上應(yīng)提供多批次參比制劑的質(zhì)量對比研究數(shù)據(jù)。
外用藥物在體外局部釋放的程度和速度是制劑性能的綜合體現(xiàn),應(yīng)提供體外釋放試驗(yàn)方法的系統(tǒng)的研究及驗(yàn)證資料,并在此基礎(chǔ)上對仿制藥與參比制劑進(jìn)行體外釋放度對比研究。(NMPA:新注冊分類的皮膚外用仿制藥的技術(shù)評價要求(征求意見稿))。
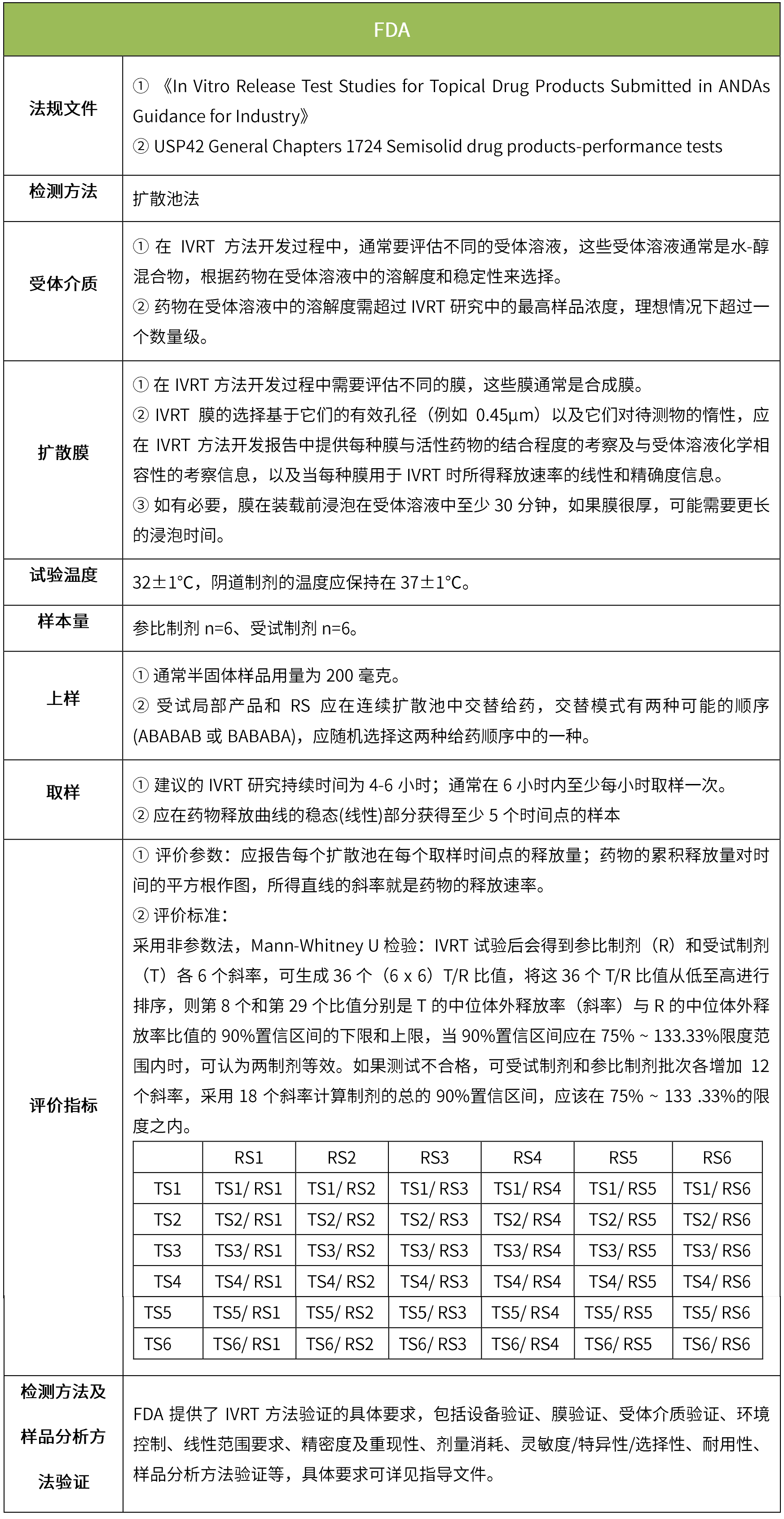
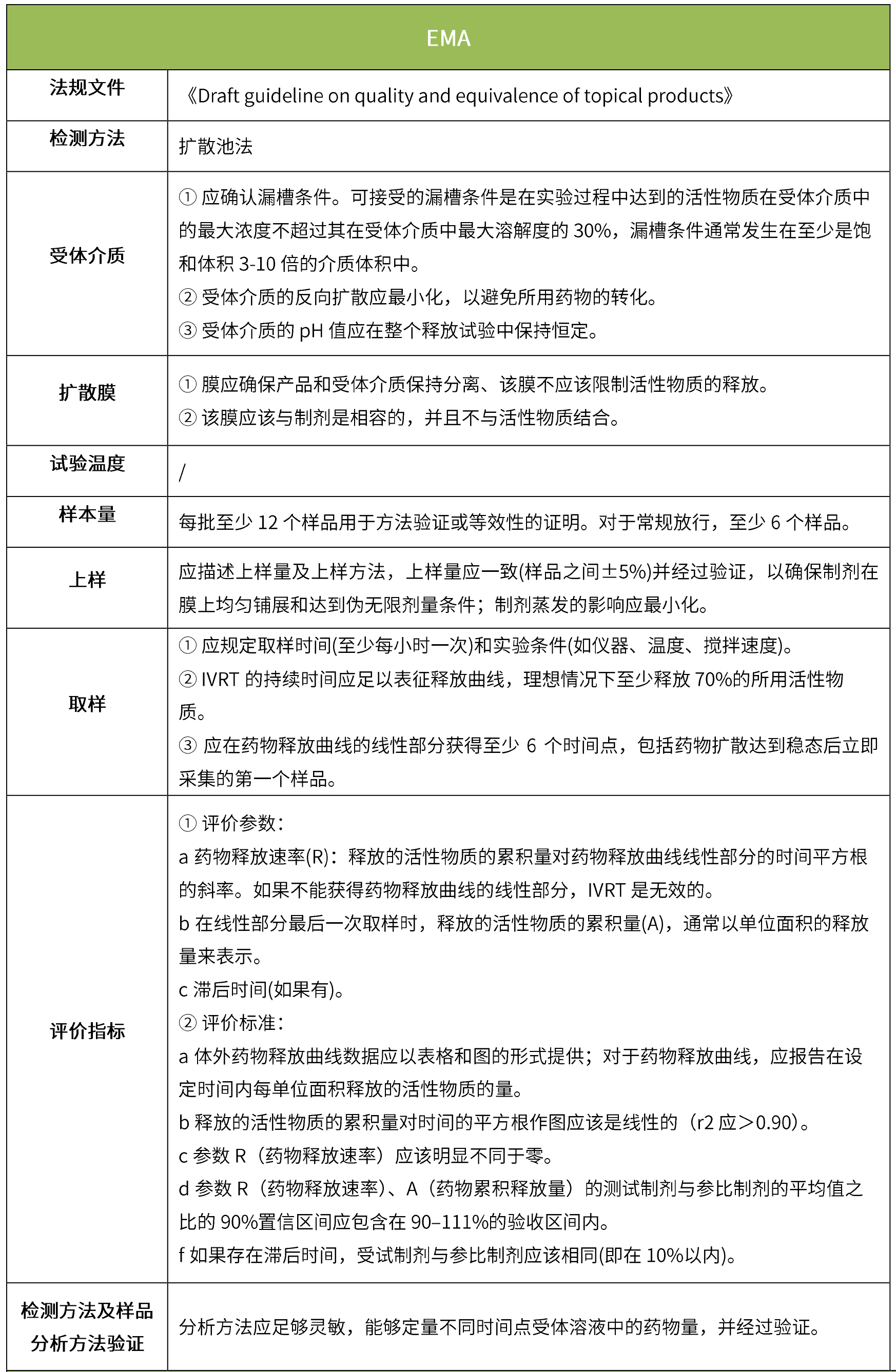
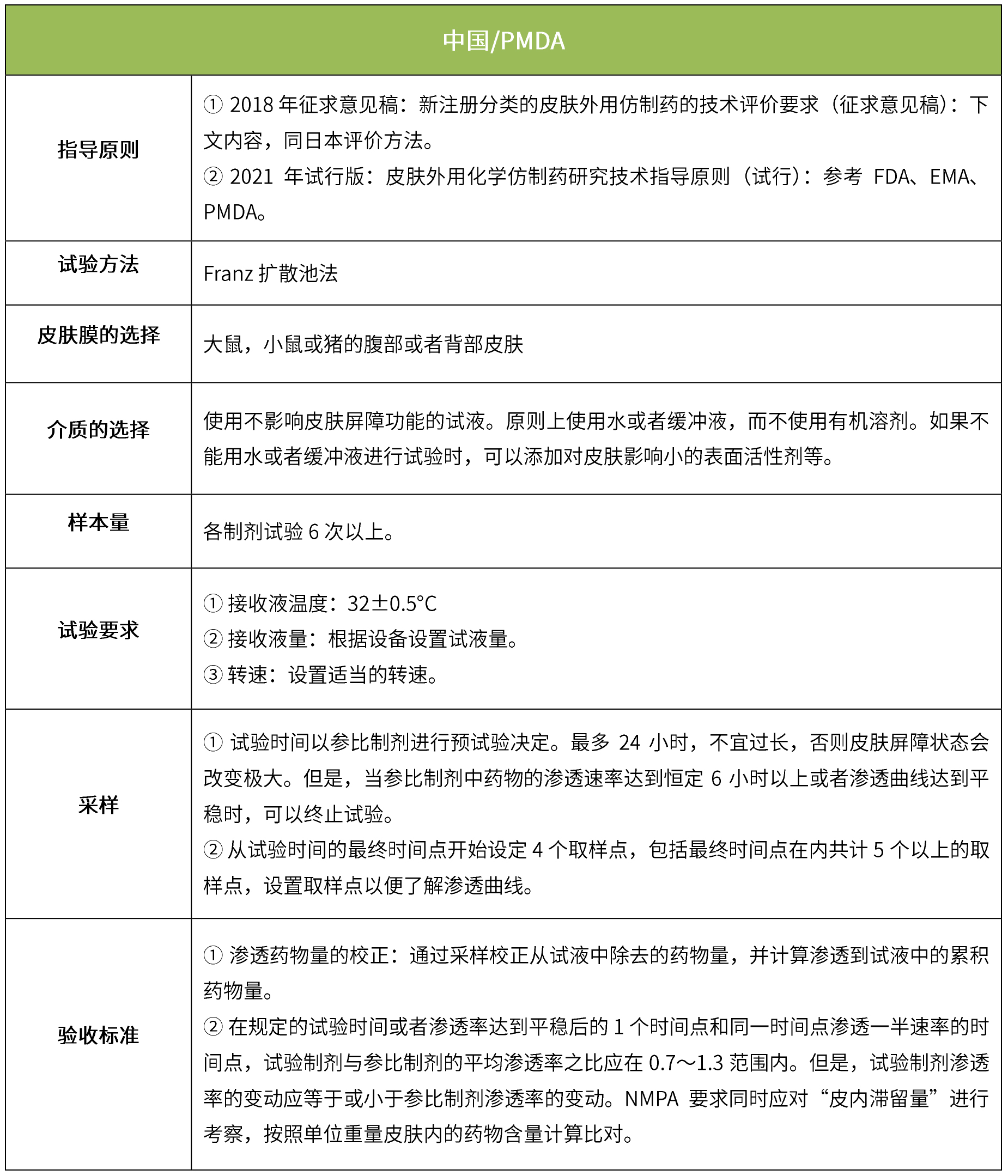
下表匯總了各國法規(guī)對IVRT的評價要求。總體而言,各國對試驗(yàn)過程的要求很多都是相同的,評價標(biāo)準(zhǔn)則不同,中國的評價標(biāo)準(zhǔn)在18年征求意見稿時與FDA一致,試行版則只提及參考FDA、EMA、PMDA,歐盟和日本的評價標(biāo)準(zhǔn)與FDA也不一致。
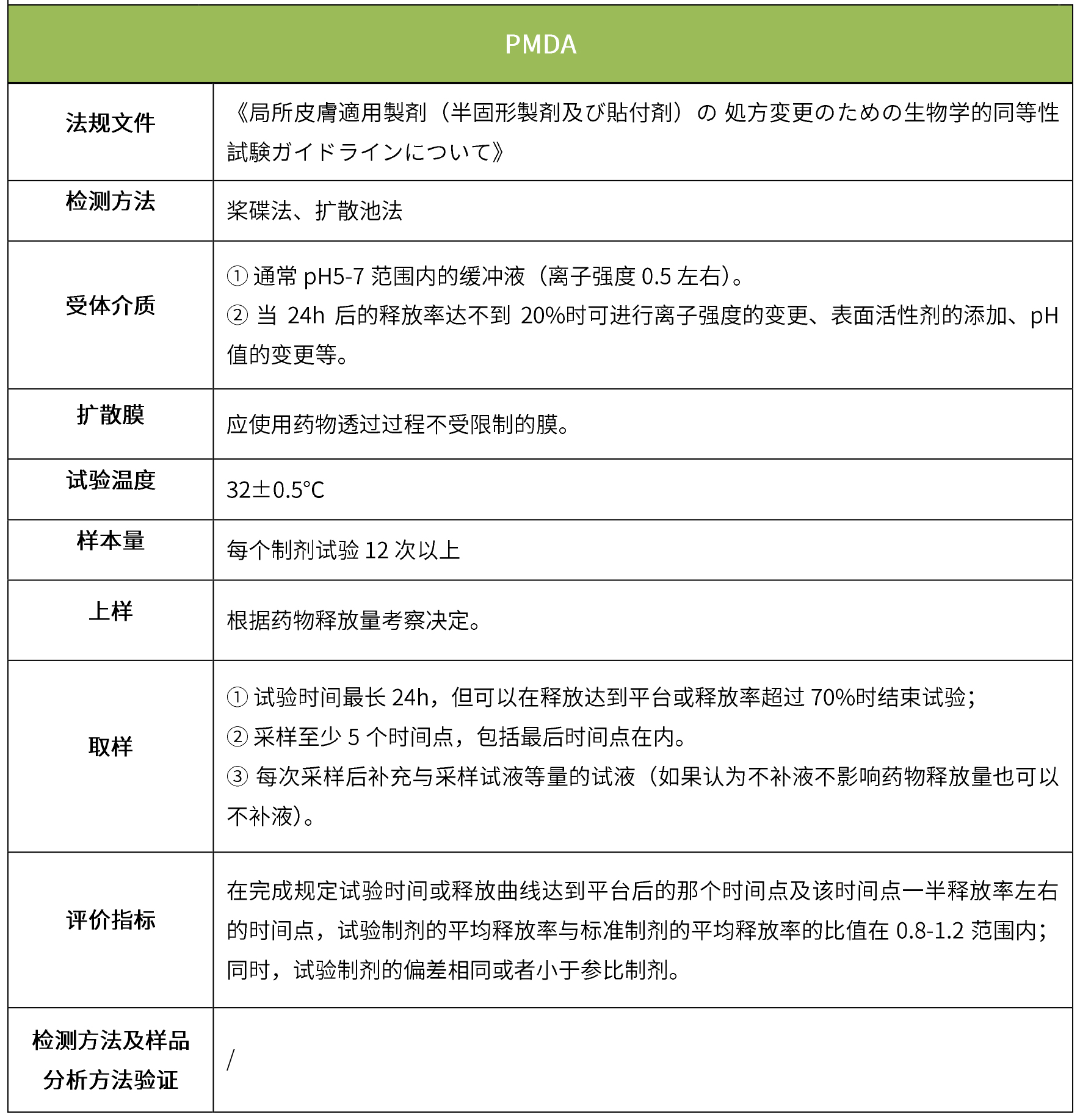
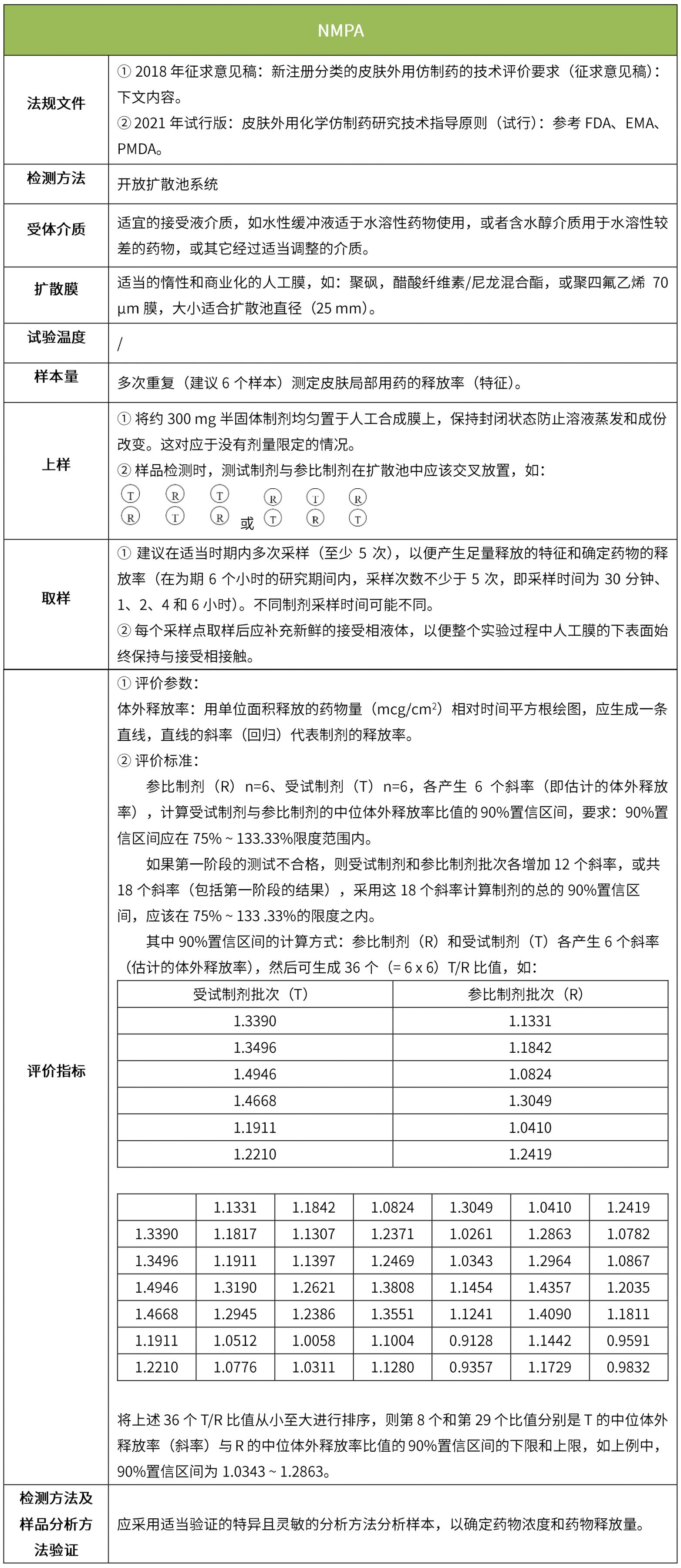
5 IVPT(體外透皮試驗(yàn))
體外透皮試驗(yàn)的設(shè)計(jì)目的是模擬外用藥物在生理?xiàng)l件下的透皮過程,以反映外用制劑的質(zhì)量;是采用特定的研究方法,動態(tài)地測量皮膚給藥后一定時間內(nèi)藥物透過皮膚的速度和藥物的量,以測定藥物透過皮膚的真實(shí)生理效果。(NMPA:《皮膚外用化學(xué)仿制藥研究技術(shù)指導(dǎo)原則(試行)》、《新注冊分類的皮膚外用仿制藥的技術(shù)評價要求(征求意見稿)》)。
下表匯總了各國法規(guī)對IVRT的評價要求。總體而言,各國對該試驗(yàn)過程的要求是不一樣的,中國的評價標(biāo)準(zhǔn)在18年征求意見稿時與日本一致,試行版則只提及參考FDA、EMA、PMDA,歐盟與FDA相比試驗(yàn)過程要求上大體一致,但在樣本量和評價標(biāo)準(zhǔn)上也不一致。
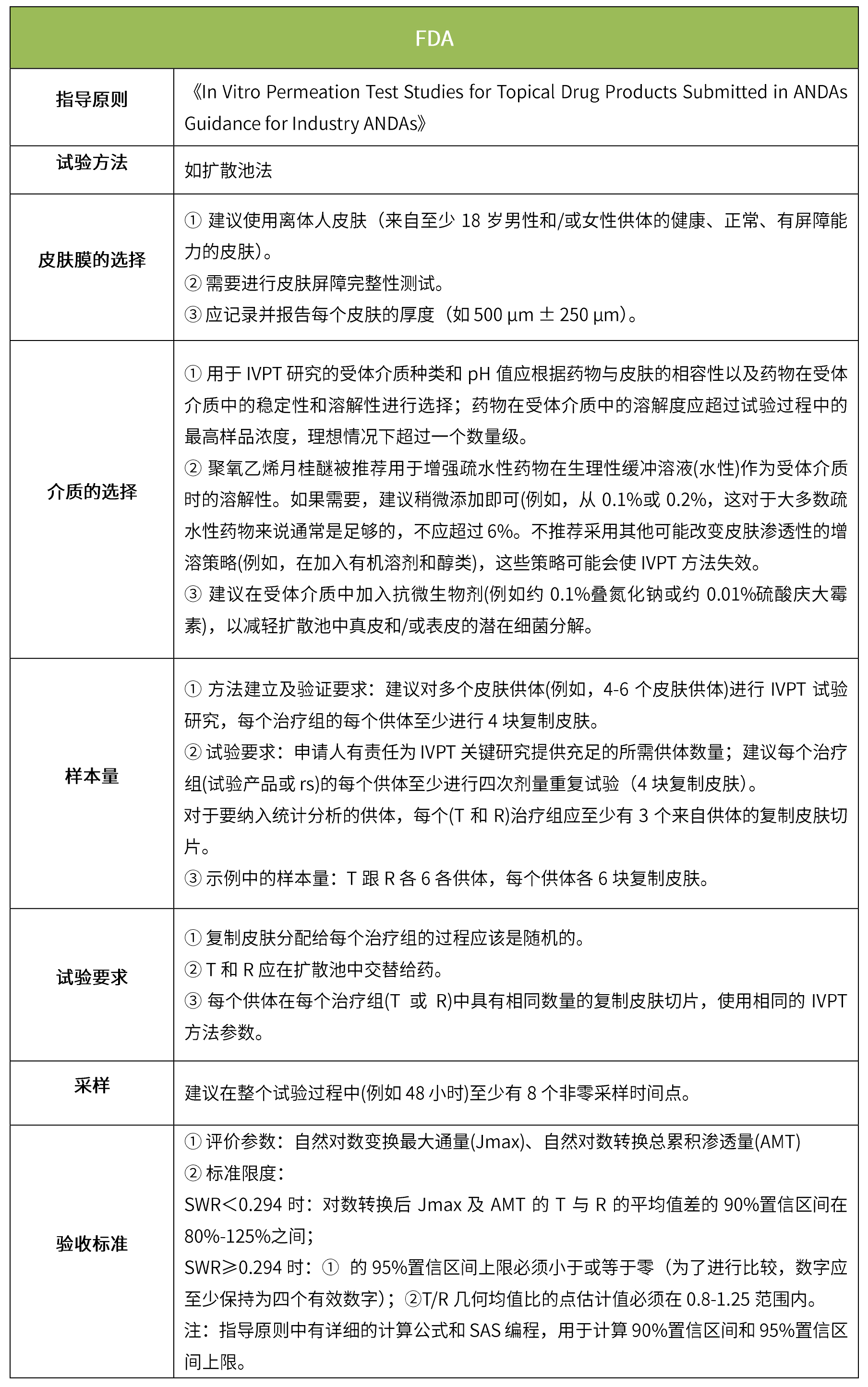
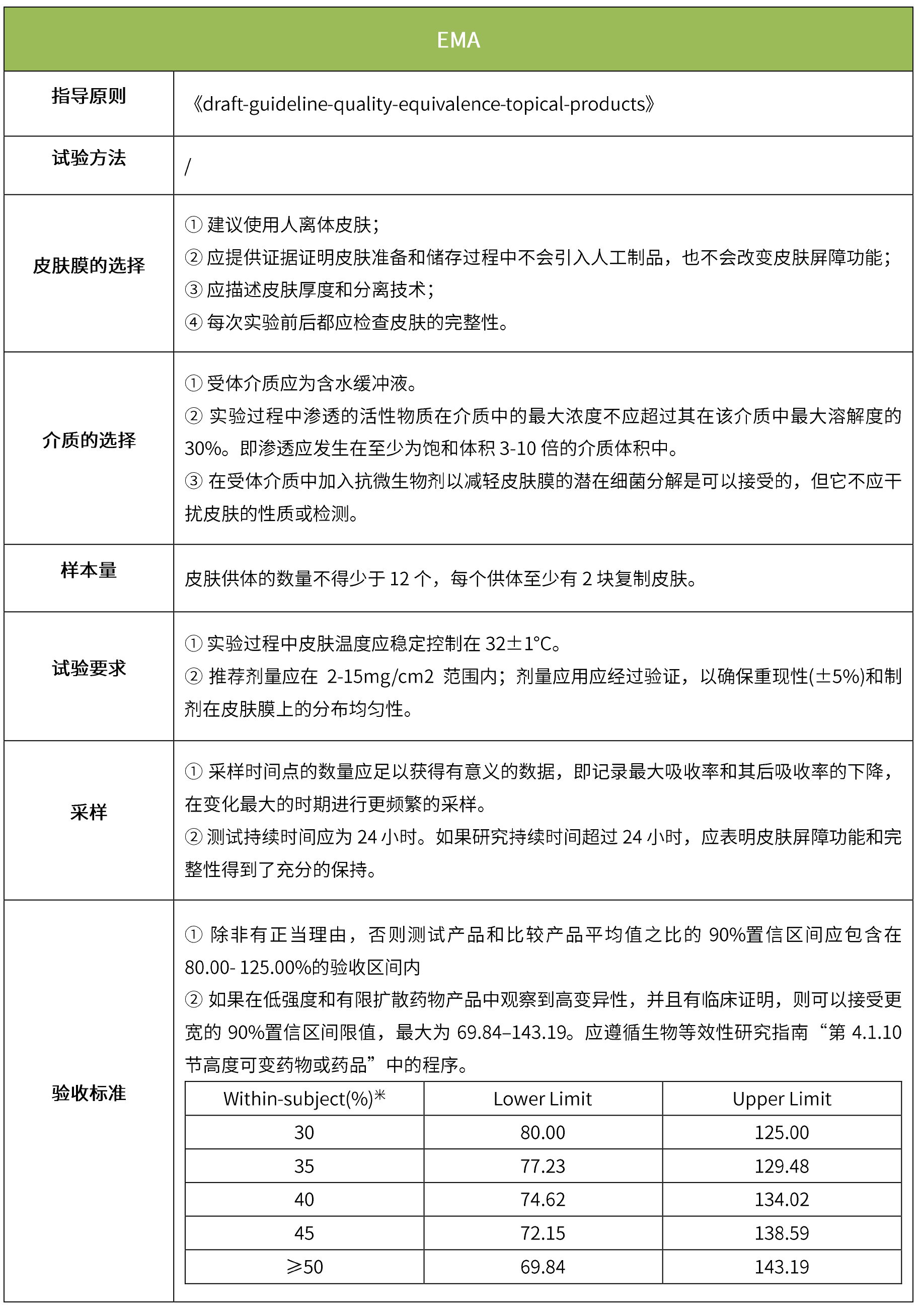
-END-


轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-61006450
Hotline服務(wù)熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場部:
技術(shù)市場部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
