政策法規(guī) || 《藥品審評(píng)中心藥物臨床試驗(yàn)期間安全信息評(píng)估與風(fēng)險(xiǎn)管理工作程序(試行)修訂稿(征求意見稿)》(附近期法規(guī)概覽)
01
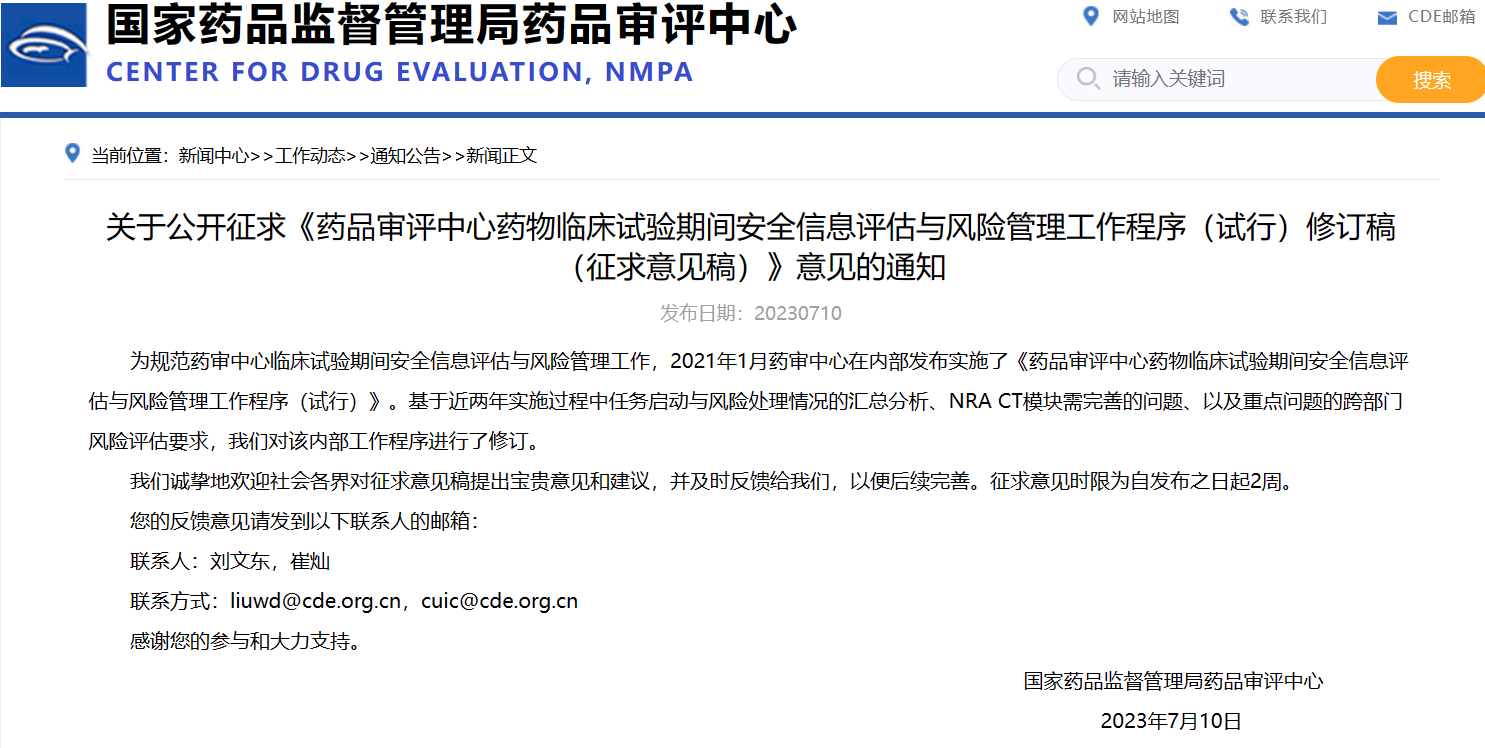
關(guān)于公開征求《藥品審評(píng)中心藥物臨床試驗(yàn)期間安全信息評(píng)估與風(fēng)險(xiǎn)管理工作程序(試行)修訂稿(征求意見稿)》意見的通知
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

02
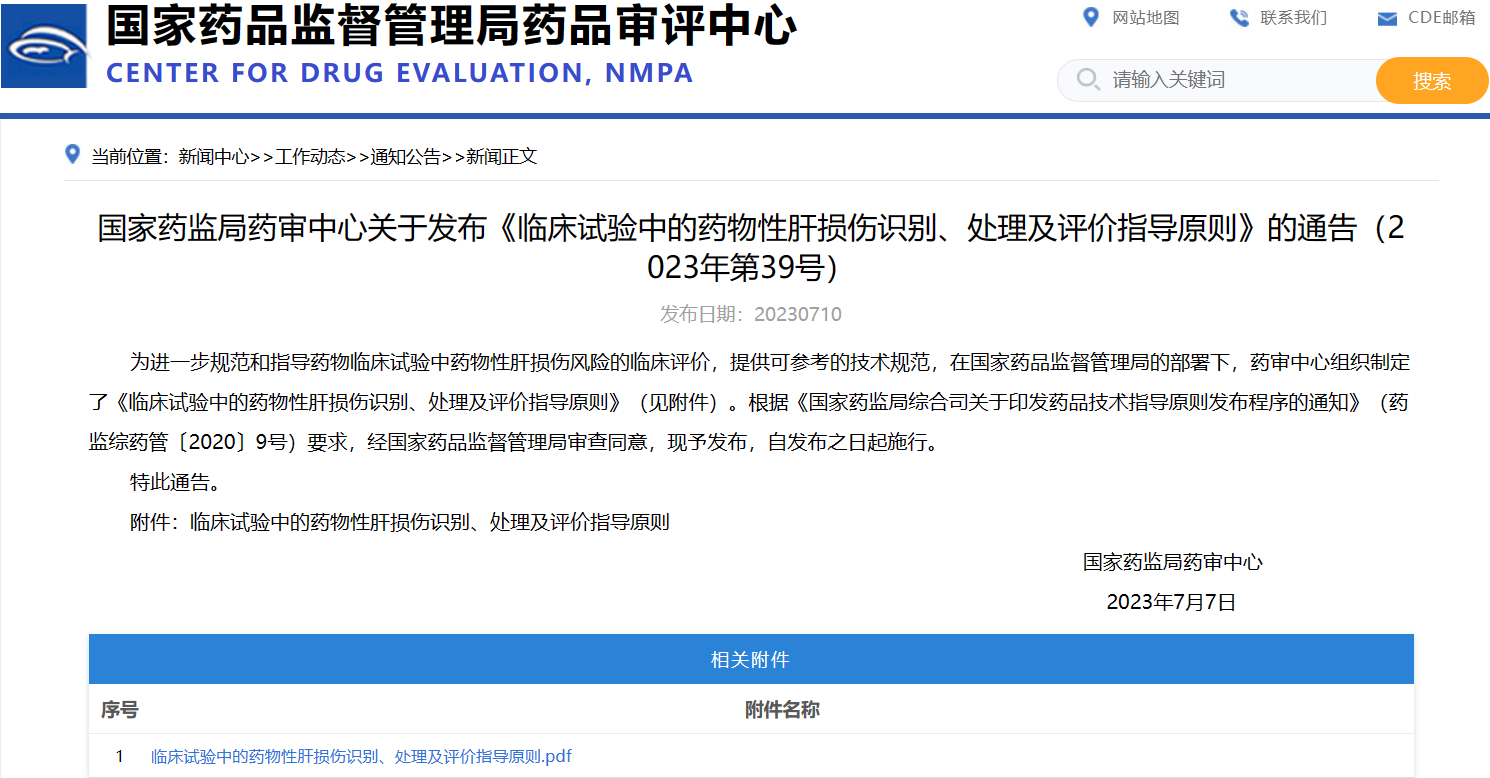
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《臨床試驗(yàn)中的藥物性肝損傷識(shí)別、處理及評(píng)價(jià)指導(dǎo)原則》的通告(2023年第39號(hào))
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

03
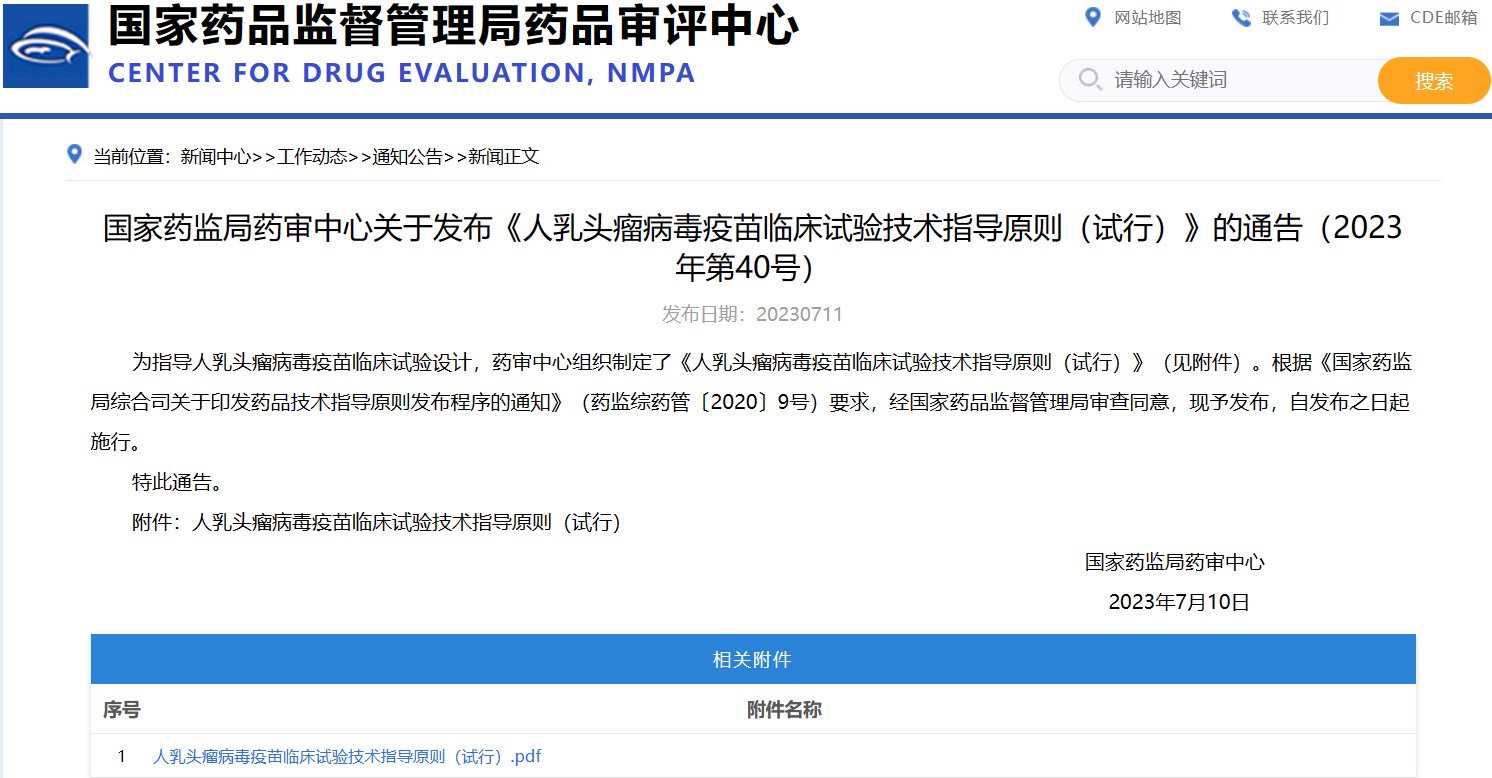
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《人乳頭瘤病毒疫苗臨床試驗(yàn)技術(shù)指導(dǎo)原則(試行)》的通告(2023年第40號(hào))
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

NMPA
01
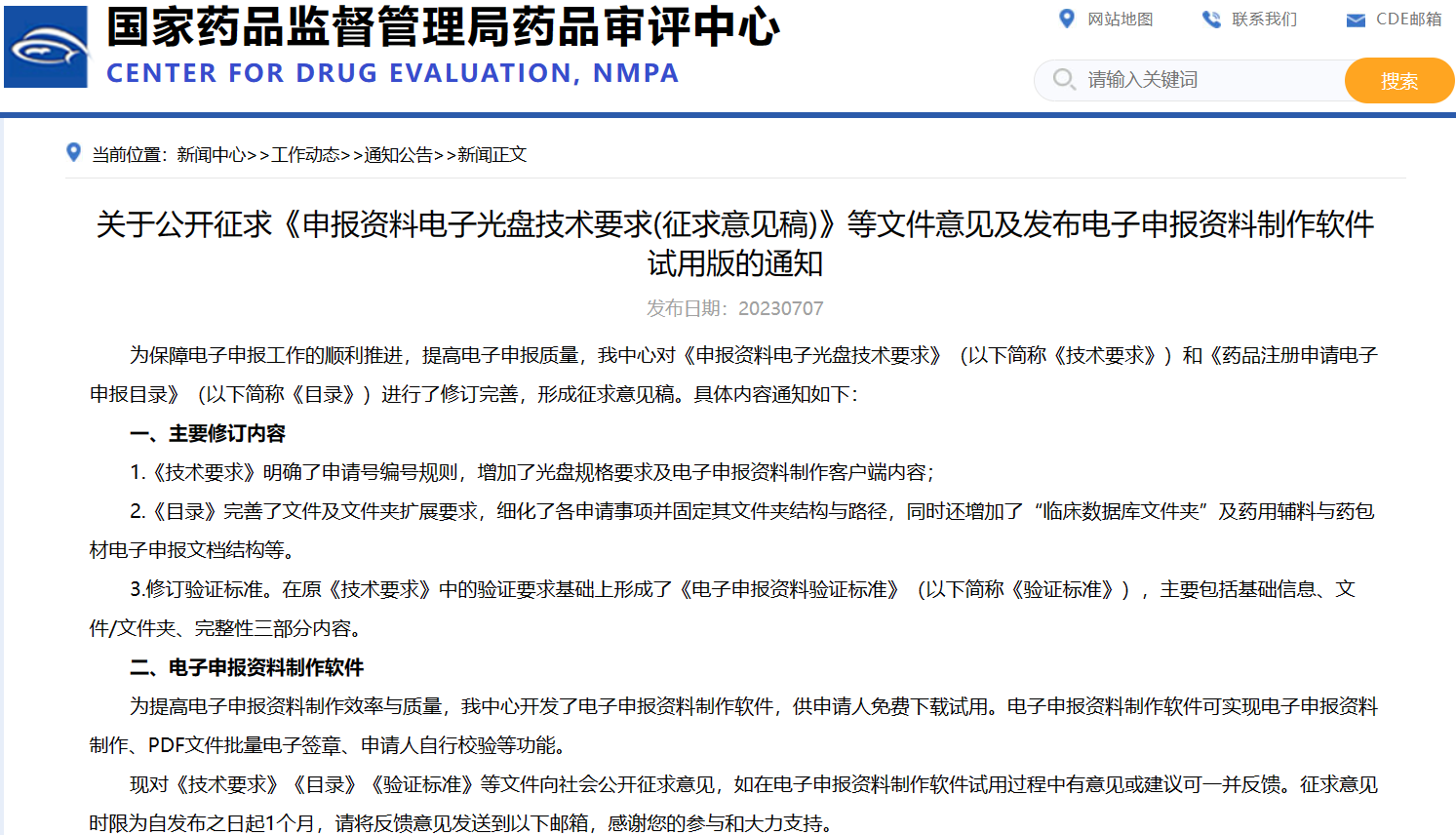
關(guān)于公開征求《申報(bào)資料電子光盤技術(shù)要求(征求意見稿)》等文件意見及發(fā)布電子申報(bào)資料制作軟件試用版的通知
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

02
關(guān)于公開征求《關(guān)于加快古代經(jīng)典名方中藥復(fù)方制劑溝通交流和申報(bào)的有關(guān)意見(征求意見稿)》意見的通知
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

03
關(guān)于公開征求《化學(xué)仿制藥參比制劑目錄(第七十二批)》(征求意見稿)意見的通知
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

04
國(guó)家藥監(jiān)局關(guān)于發(fā)布《已上市藥品說(shuō)明書增加兒童用藥信息工作程序(試行)》的公告(2023年第68號(hào))
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

05
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《化學(xué)原料藥受理審查指南(試行)》的通告(2023年第38號(hào))
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

06
2023年07月11日中藥品種保護(hù)受理公示

掃描識(shí)別圖中二維碼
查看詳細(xì)信息

07
國(guó)家藥監(jiān)局關(guān)于發(fā)布《藥品標(biāo)準(zhǔn)管理辦法》的公告(2023年第86號(hào))
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

08
國(guó)家藥監(jiān)局關(guān)于適用《M10:生物分析方法驗(yàn)證及樣品分析》國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)指導(dǎo)原則問(wèn)答文件和常見問(wèn)題解答文件的公告(2023年第84號(hào))

掃描識(shí)別圖中二維碼
查看詳細(xì)信息

非處方藥轉(zhuǎn)換眾生片的公示
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

-END-


轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來(lái)源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-61006450
Hotline服務(wù)熱線:010-61006450
 簡(jiǎn)體中文
簡(jiǎn)體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場(chǎng)部:
技術(shù)市場(chǎng)部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
