收藏 | 特醫食品注冊申報的那些事
特醫食品區別于普通食品,是可以滿足特定人群或特定疾病病人的特殊膳食需求的食品,包括適用于0月齡至12月齡的特殊醫學用途嬰兒配方食品和適用于1歲以上人群的特殊醫學用途配方食品。本文針對特醫食品注冊申報相關信息進行匯總。
注冊申請人應當為以下兩種情況:
-
擬在境內生產并銷售特殊醫學用途配方食品的生產企業
-
擬向境內出口特殊醫學用途配方食品的境外生產企業
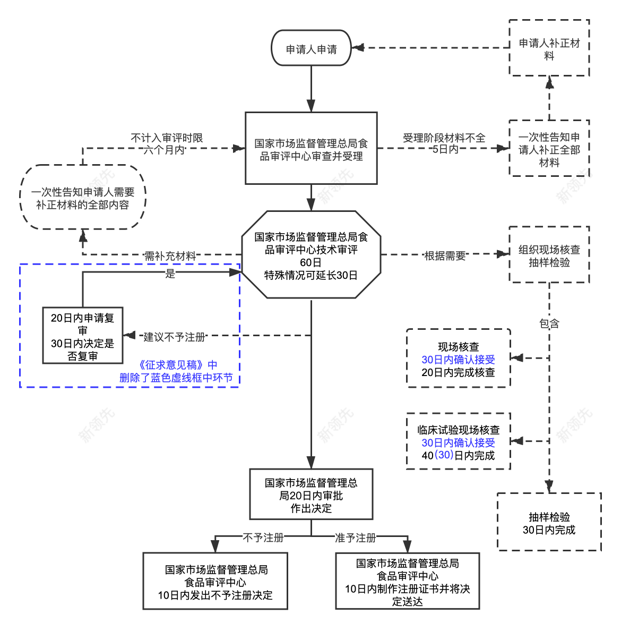

▲ 特醫食品申報流程圖表
? 優先審評審批程序
? 適用范圍:
-
罕見病類特殊醫學用途配方食品
-
臨床急需且尚未批準過的新類型特殊醫學用途配方食品
-
國家市場監督管理總局規定的其他優先審評審批的情形
? 政策支持:
注冊前需提前食品審評機構溝通交流,經溝通確認后方可在提出注冊申請時,同時提出優先審評審批申請。符合條件的,經公示后納入優先審評審批程序。注冊申請的審評時限縮短到30個工作日,審評機構將優先安排現場核查、抽樣檢驗,經溝通交流確認后,可以補充提交技術材料。
? 產品名稱包括通用名稱、商品名稱,申請注冊的進口特殊醫學用途配方食品還可標注英文名稱,英文名稱應與中文名稱有對應關系。
? 通用名稱應當反映食品的真實屬性(指產品形態、食品分類屬性等),使用《食品安全國家標準特殊醫學用途嬰兒配方食品通則》(GB25596)、《食品安全國家標準特殊醫學用途配方食品通則》(GB29922)中規定的分類(類別)名稱或者等效名稱。
? 商品名稱應當符合法律、法規、規章和食品安全國家標準的規定,可以采用商標名稱、牌號名稱等。產品的商品名稱不得與已經批準注冊的藥品、保健食品及特殊醫學用途配方食品名稱相同。
? 其他需要說明的問題:
-
對其他需要說明的問題進行概述;
-
產品曾經不予注冊的,對相關情況及原因進行說明。
? 產品配方設計及其依據:產品配方設計應該符合相應的《食品安全國家標準》(GB25596或GB29922);特定全營養配方食品和非全營養配方食品注冊,應對產品的配方特點、配方原理或營養學特征進行描述或說明。
? 產品配方:配方中食品原料、食品輔料、營養強化劑、食品添加劑的種類應符合相應食品安全國家標準和(或)有關規定。
? 產品研發報告:對產品研發目的、研發情況和主要研究結果進行概括和總結;特殊醫學用途嬰兒配方食品和全營養配方食品注冊,應按要求提交穩定性研究研究報告。
? 生產工藝文本。文本主要內容:詳細描述生產工藝步驟,如預處理、投料、制備、滅菌、包裝等,提供各工藝步驟技術參數。
? 對生產場所和所用設備的說明。如生產車間的潔凈度級別、溫濕度要求、設備名稱和型號等。
? 說明影響產品質量的關鍵環節及質量控制措施。
? 不同品種的產品在同一條生產線上生產時,提供有效防止交叉污染所采取的措施及相關材料。
? 生產工藝流程圖,注明相關技術參數。
? 研發能力證明材料。包括:產品配方設計及其依據、產品研發報告等。
? 生產能力證明材料:
-
產品已上市的申請人應提交以下材料:已取得食品生產許可證的境內申請人,應提交食品生產許可證復印件(含正本、副本及品種明細);已取得進口資質特殊醫學用途配方食品的境外申請人,應提交良好生產管理規范和(或)相應生產質量管理體系的證明材料。
-
產品未上市或未取得生產許可的申請人應提交的材料包括:與產品生產相適應的食品安全管理人員、食品安全專業技術人員基本情況表;生產場所的主要設施、設備清單;申請人按照良好生產管理規范要求建立與所生產食品相適應的生產質量管理體系的相關證明材料。
-
檢驗能力證明材料。包括:自行檢驗的,應提交檢驗人員、檢驗設備設施、全項目資質的基本情況;不具備自行檢驗能力的,應提交實施逐批檢驗的檢驗機構名稱、法定資質證明以及申請人與該檢驗機構的委托合同等。
? 申請特定全營養配方食品注冊的,應當按照《特殊醫學用途配方食品臨床試驗質量管理規范(試行)》進行臨床試驗,并出具臨床試驗報告。
? 產品申請注冊時,除臨床試驗報告外,申請人還需提交臨床試驗相關材料,包括:國內和(或)國外臨床試驗材料綜述、具有法定資質的食品檢驗機構出具的試驗用產品合格的檢驗報告、臨床試驗方案、研究者手冊、倫理委員會批準意見、知情同意書模板、數據管理計劃及報告、統計分析計劃及報告、鎖定數據庫光盤、其他材料等。
? 申請人主體登記證明文件復印件。
? 產品含注冊商標的,應提供國家商標注冊管理部門批準的商標注冊證書復印件,商標使用范圍應符合要求。商標注冊人與申請人不一致的,應提供申請人可以合法使用該商標的證明文件。
? 申請進口特殊醫學用途配方食品注冊,應提交以下證明性文件:(申請人應當確保譯本的真實性、準確性與一致性)
-
產品生產國(地區)政府主管部門或者法律服務機構出具的境外申請人為境外生產企業的資質證明文件復印件及其中文譯本。
-
產品生產國(地區)政府主管部門或者法律服務機構出具的允許產品上市銷售的證明復印件及其中文譯本,產品未上市銷售的,可不提供。
-
由境外申請人常駐中國代表機構辦理注冊事務的,應當提交《外國企業常駐中國代表機構登記證》復印件。
-
境外申請人委托境內代理機構辦理注冊事項的,應當提交經過公證的授權委托書原件及其中文譯本,以及受委托的代理機構營業執照復印件。
-
授權委托書中應載明出具單位名稱、被委托單位名稱、委托申請注冊的產品名稱、委托事項及授權委托書出具日期。授權委托書的委托方應與申請人名稱一致。
? 在提交紙質申請材料之前,應先完成電子申請程序:通過國家市場監督管理總局網站或總局食品審評機構網站進入特殊醫學用途配方食品注冊申請系統填寫并打印注冊申請書(填寫完電子版打印并蓋章)。
? 同時提交紙質申請材料。
? 申請材料一般要求:
-
進入在線申請系統按規定填寫并打印注冊申請書。
-
在注冊申請書后附上相關申請材料,順序按申請書中列明順序排列。
-
申請材料首頁為材料目錄,整套材料需裝訂成冊并有詳細目錄。
-
每項材料需有封頁,封頁上應注明產品名稱、申請人名稱,右上角注明該項材料名稱。
-
各項材料之間應當使用明顯的區分標志,并標明各項材料名稱或該項材料所在目錄中的序號。
-
材料使用A4紙完整清楚打印(中文不得小于四號字,英文不得小于12號字),不得有涂改。
-
申請材料應騎縫加蓋申請人公章(檢驗機構出具的報告除外),材料內蓋章需加蓋在文字處。
-
注意信息一致性。
-
申請中的外文材料應翻譯為規范的中文。
-
應同時提交申請原件、復印件和電子版。復印件和電子版的內容應與原件一致。
-
注冊申請需提交原件1份、復印件7份;變更、延續注冊提交原件1份、復印件7份。
-
電子版上傳系統的應是加蓋公章后的版本。
-
《特殊醫學用途配方食品注冊管理辦法》2016
-
《特殊醫學用途配方食品臨床試驗質量管理規范(試行)》2016
-
《特殊醫學用途配方食品注冊生產企業現場核查要點及判斷原則(試行)》2016
-
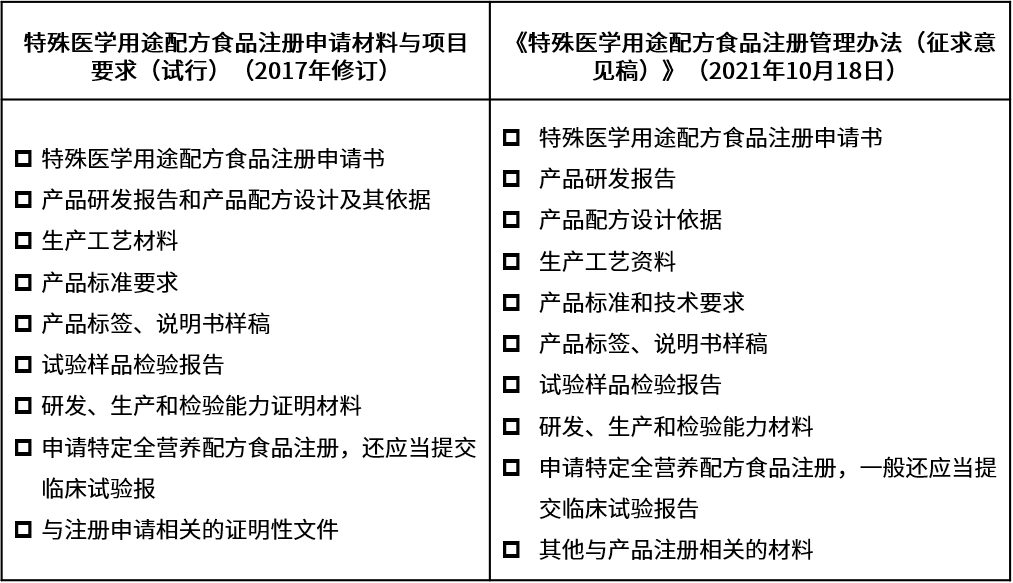
《特殊醫學用途配方食品注冊申請材料項目與要求(試行)》(2017修訂版)
-
《市場監管總局關于調整特殊醫學用途配方食品產品通用名稱的公告》 2019
-
《特殊醫學用途配方食品生產許可審查細則》2019
深藍海生物醫藥是新領先在臨床 CRO 領域的子品牌,成立于2007年,目前已擁有高專業水準的臨床服務團隊600余人,已為300余家國內外知名企業提供多元化的研發支持臨床技術服務,項目全面覆蓋生物藥、化藥、中藥、醫療器械、細胞與基因治療等藥物,滿足不同研發型企業的臨床研究定制需求,為國內外客戶打通新藥上市前關鍵瓶頸。
通過16年經驗積累,深藍海生物醫藥已經完成臨床研究500余項,每年開展Ⅰ類創新藥研究10-20項,率先開展醫美、特醫食品、細胞與基因治療藥物等領域研究,填補國內外多項空白。
依托于新領先CXO服務體系,創建了“交互式”臨床服務模式,在項目立項階段全面介入,做新藥創制的全程合作伙伴,整合醫學、藥政、藥學研發等技術專家進行頂層設計,最大限度降低項目研發風險。同時,成立專項政府引導基金,為創新項目提供不同階段的投融資,最大程度加速藥品上市進程。此外,強大的定量藥理學及體內外橋接團隊針對特定疾病和特定人群進行數字模型研究,制定科學高質的臨床研究方案,提高新藥臨床開發效率。
-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
