政策法規 ||《化學藥品創新藥Ⅲ期臨床試驗前會議藥學共性問題及相關技術要求(試行)》附法規概覽03.20-03.24)
01
國家藥監局藥審中心關于發布《化學藥品創新藥Ⅲ期臨床試驗前會議藥學共性問題及相關技術要求(試行)》的通告(2023年第23號)

掃描識別圖中二維碼
查看詳細信息

02
國家藥監局藥審中心關于發布《治療卵巢癌新藥臨床研發技術指導原則(試行)》的通告(2023年第21號)

掃描識別圖中二維碼
查看詳細信息

03
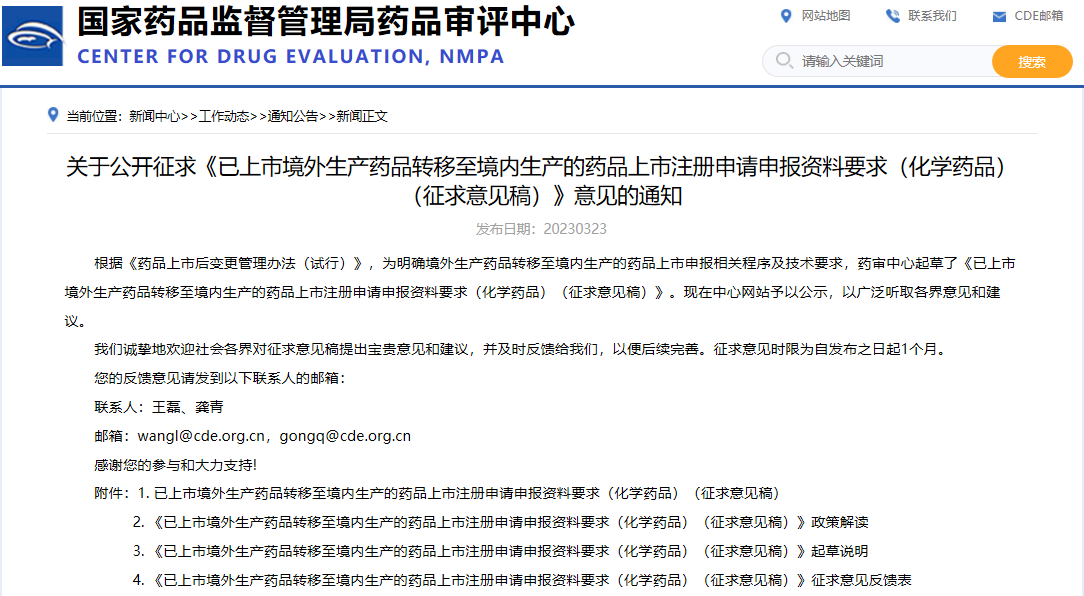
關于公開征求《已上市境外生產藥品轉移至境內生產的藥品上市注冊申請申報資料要求(化學藥品)(征求意見稿)》意見的通知
掃描識別圖中二維碼
查看詳細信息

01
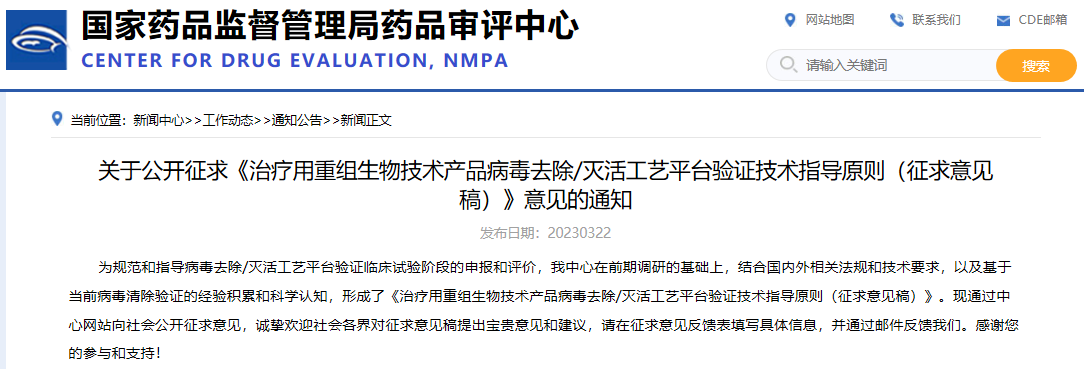
關于公開征求《治療用重組生物技術產品病毒去除/滅活工藝平臺驗證技術指導原則(征求意見稿)》意見的通知
掃描識別圖中二維碼
查看詳細信息

02
國家藥監局藥審中心關于發布《化藥口服固體制劑連續制造技術指導原則(試行)》的通告(2023年第19號)

掃描識別圖中二維碼
查看詳細信息

03
國家藥監局藥審中心關于發布《化學藥品說明書及標簽藥學相關信息撰寫指導原則(試行)》的通告(2023年第20號)

掃描識別圖中二維碼
查看詳細信息

04
國家藥監局藥審中心關于發布《兒童抗腫瘤藥物臨床研發技術指導原則》的通告(2023年第22號)

掃描識別圖中二維碼
查看詳細信息

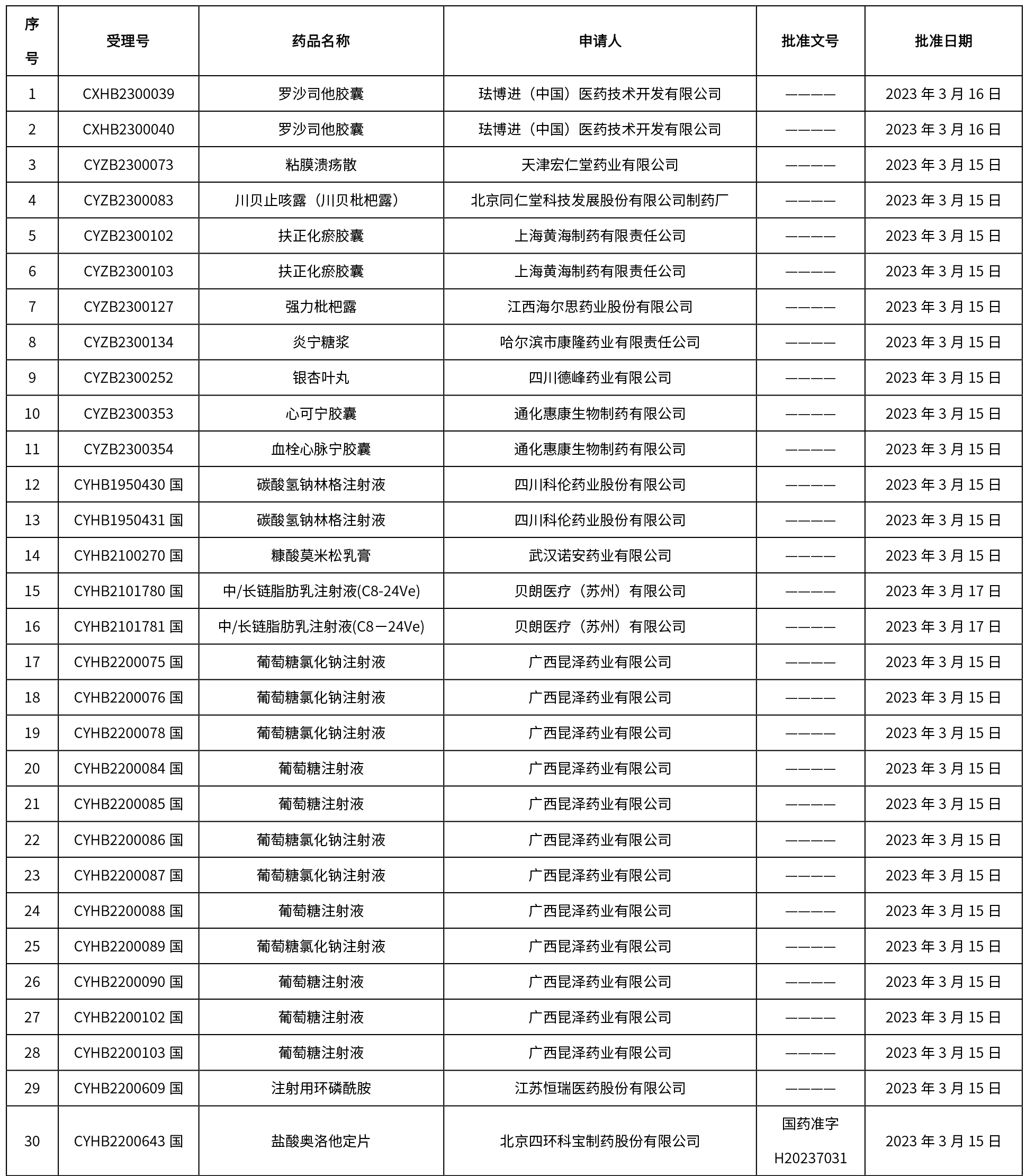
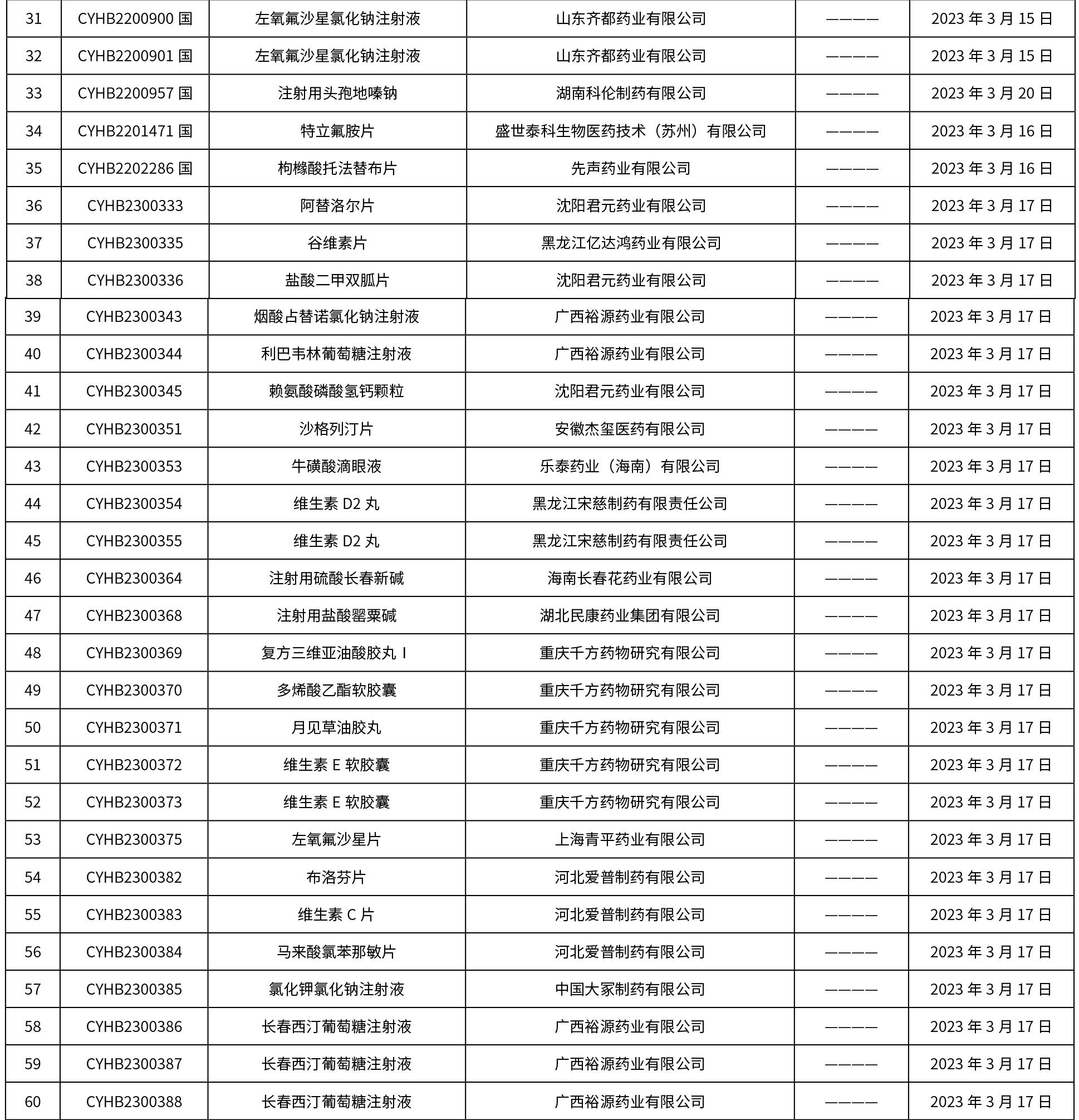
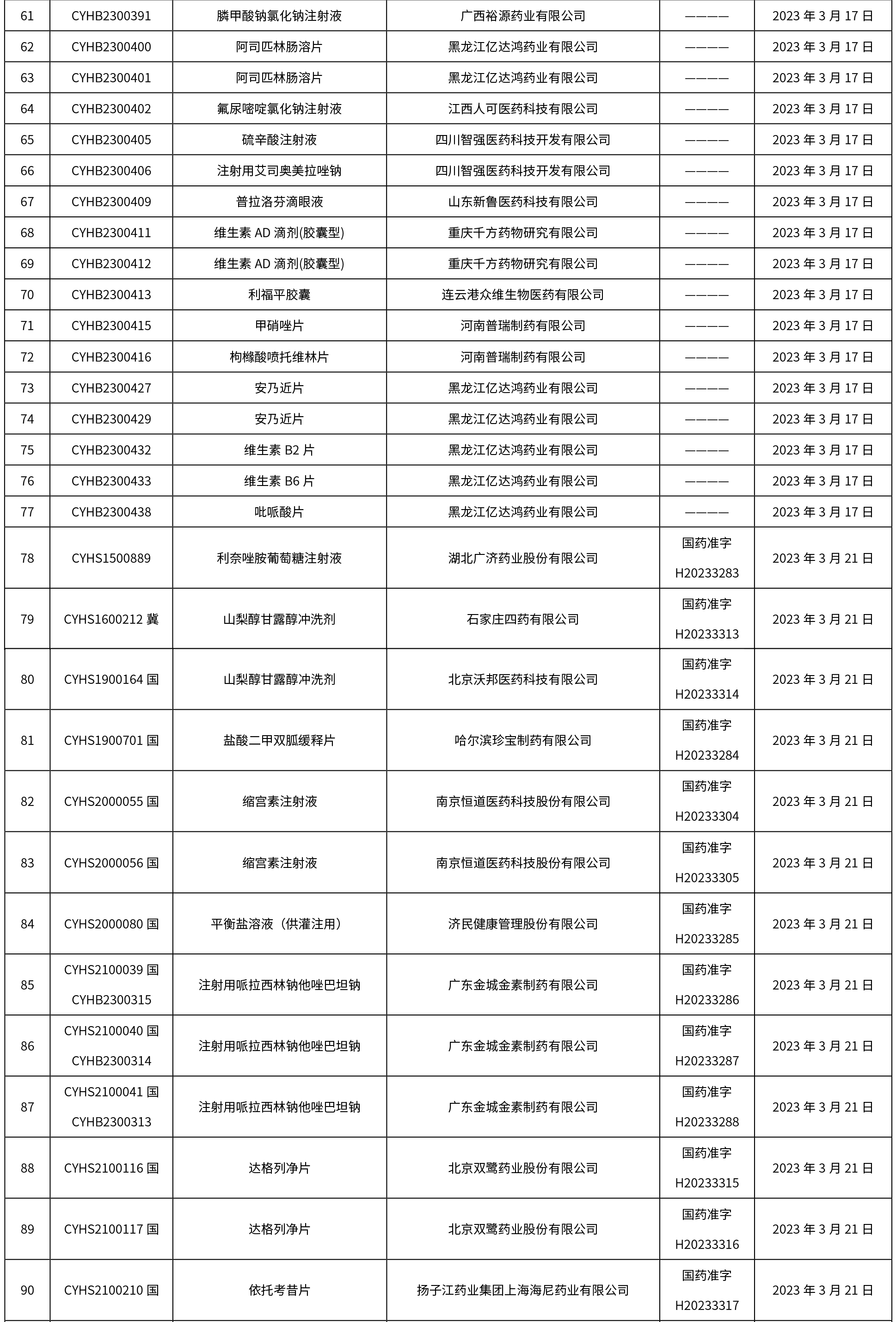
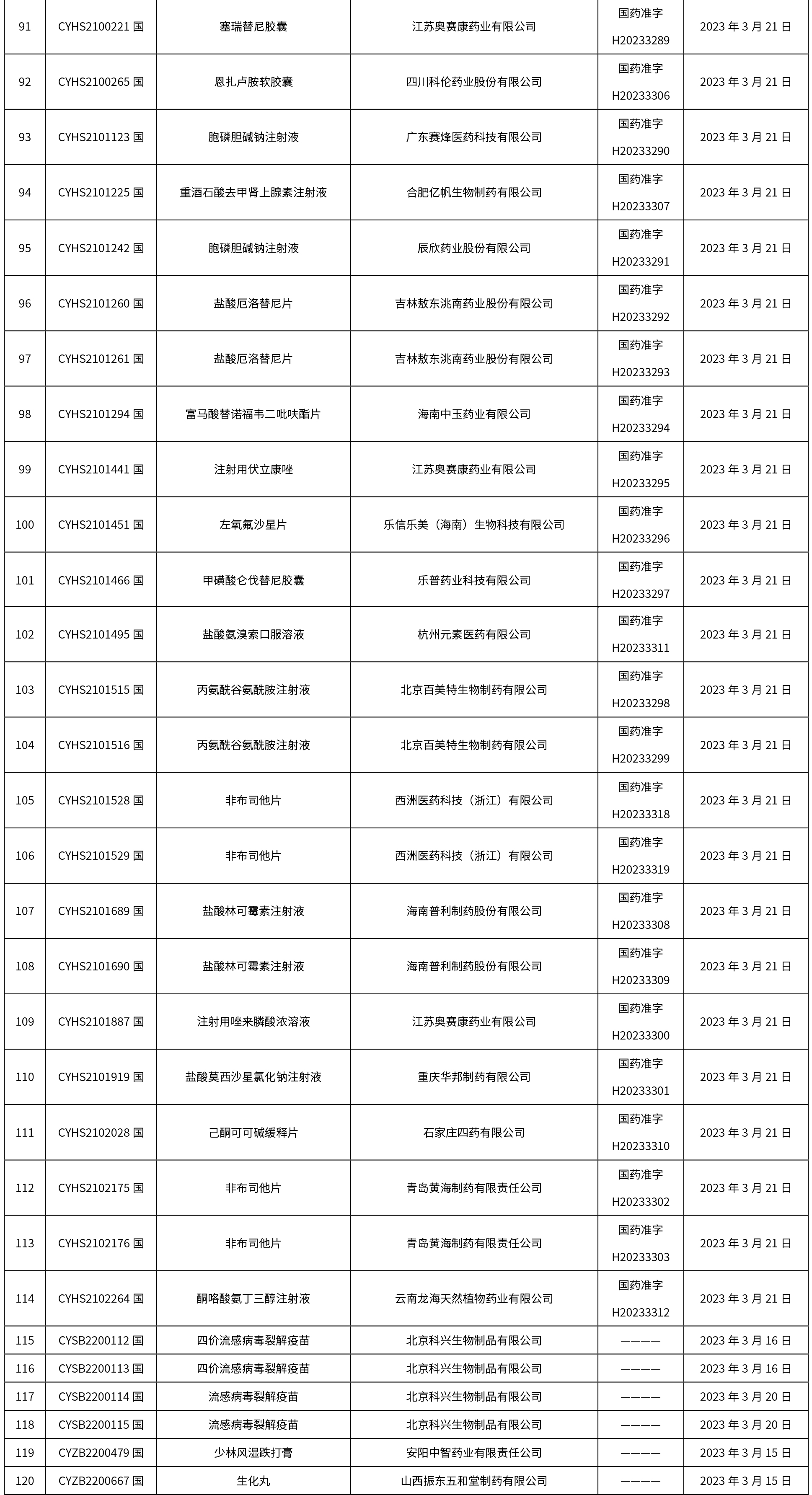
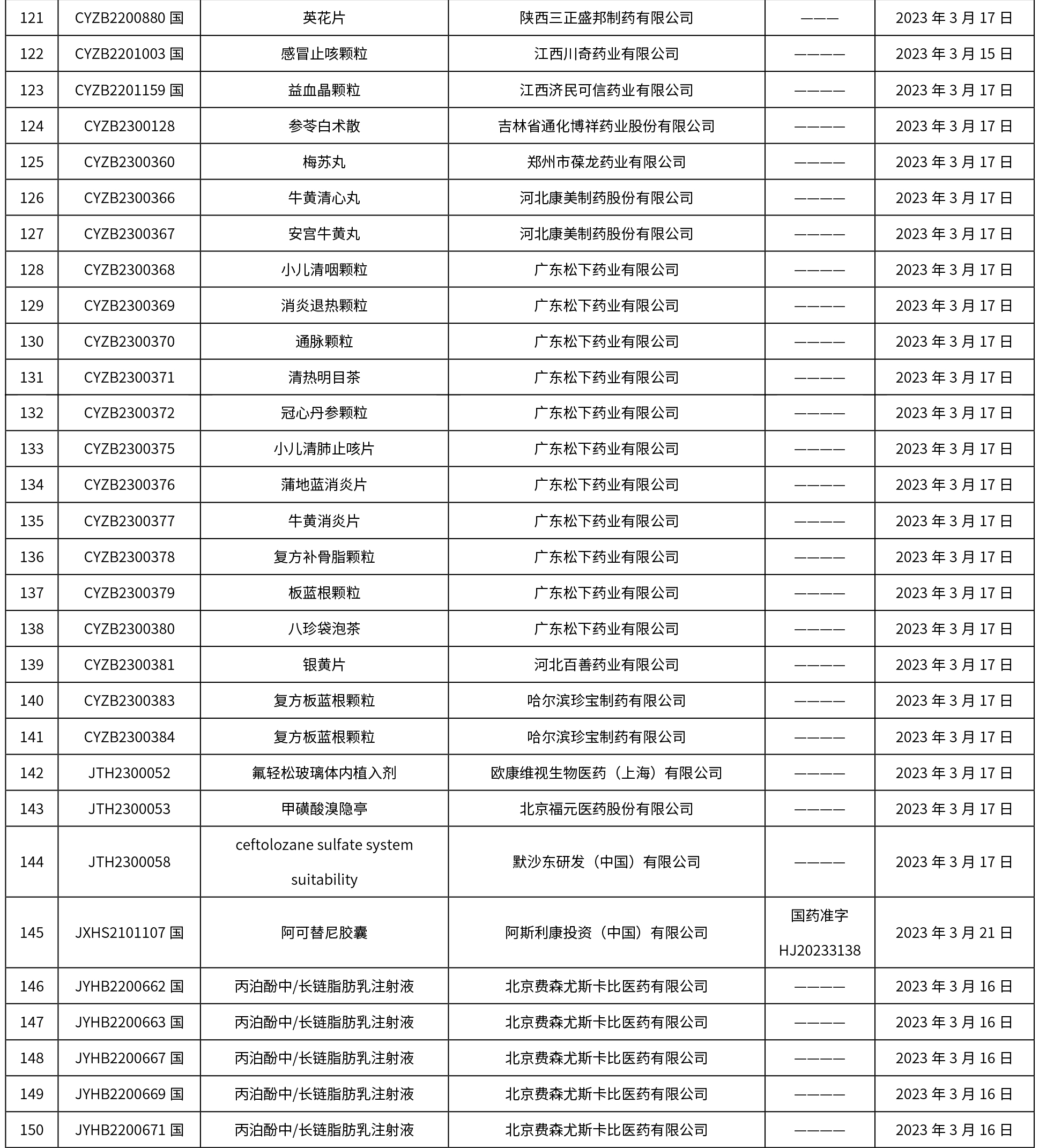
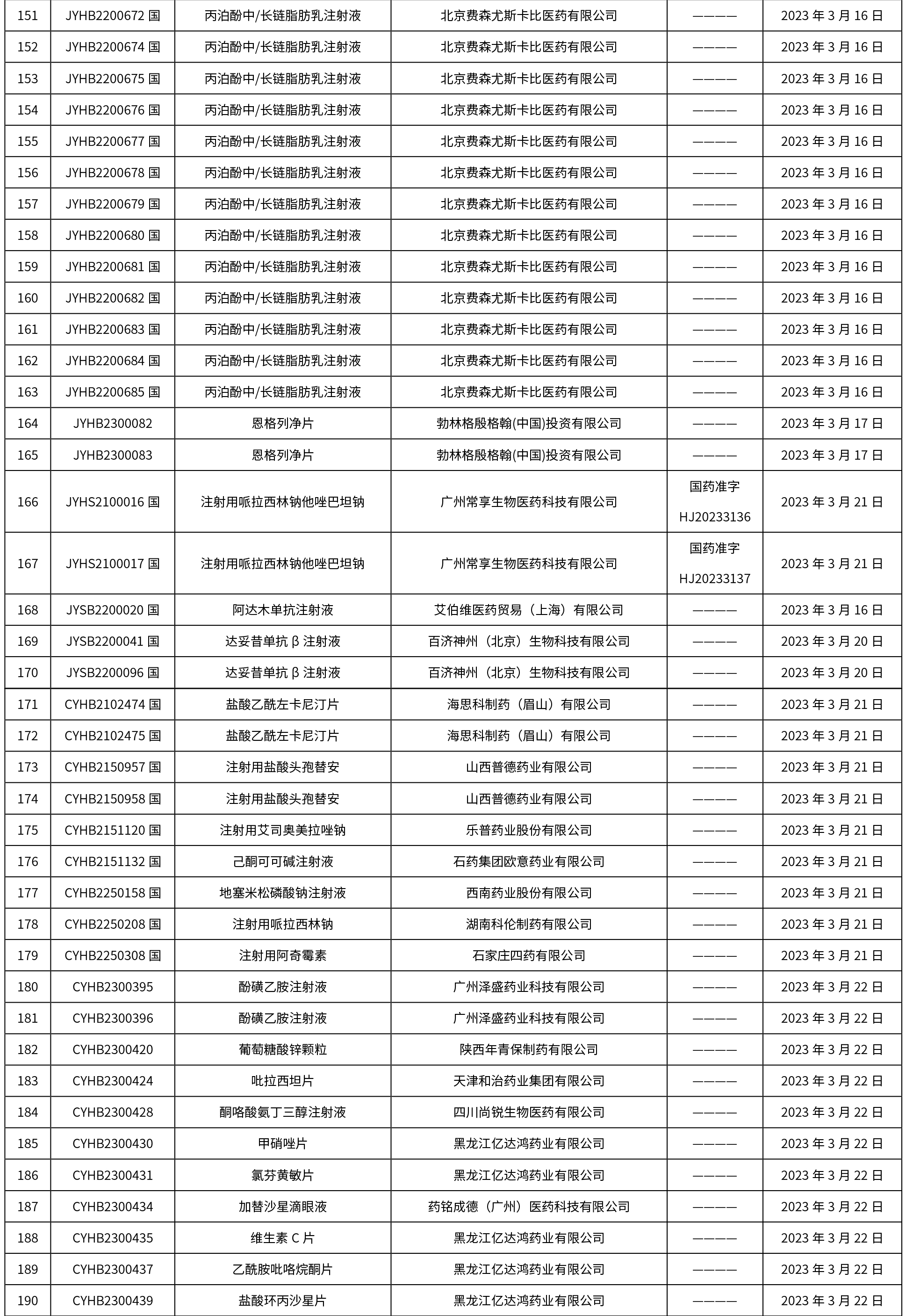
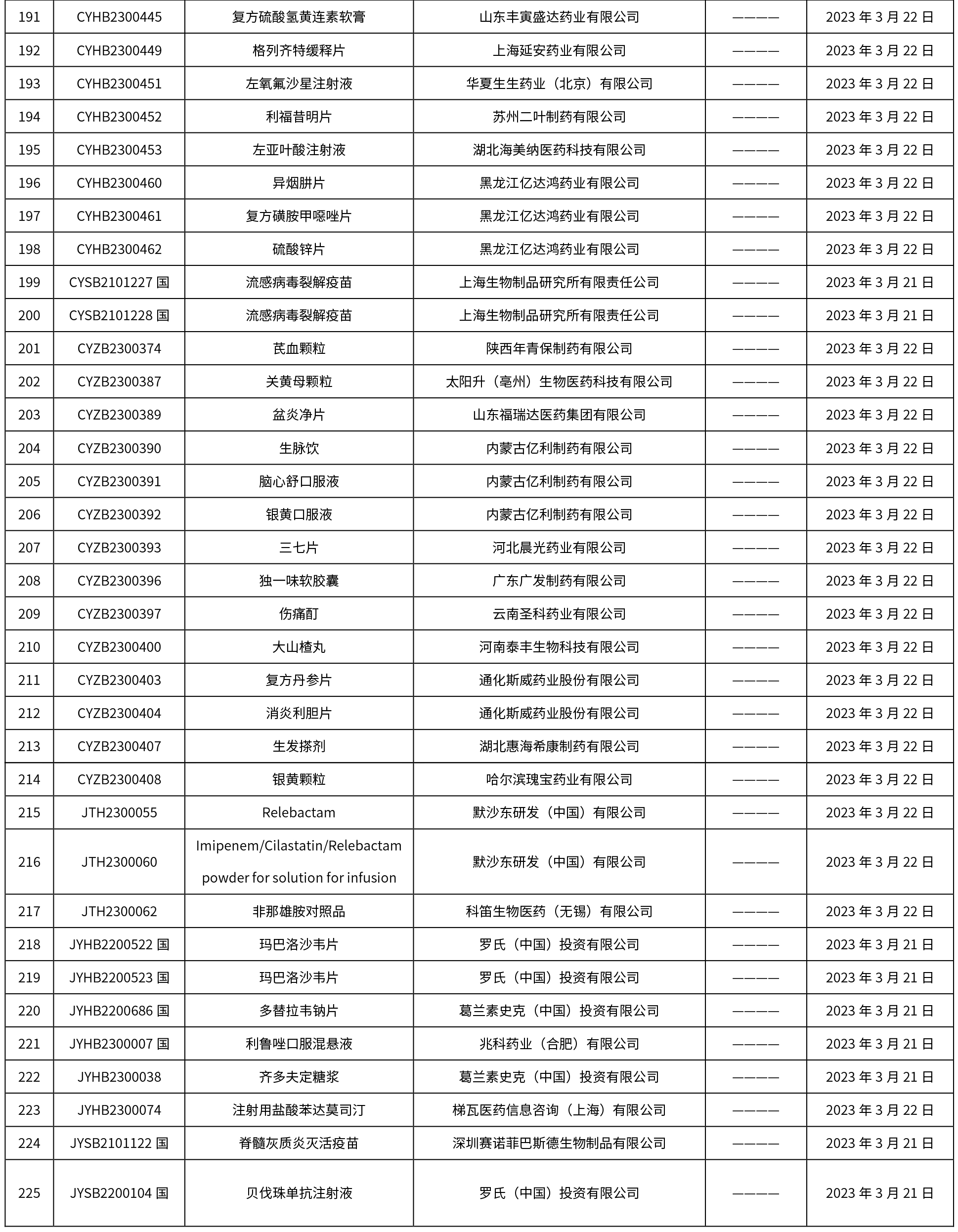
本周共發布了225個品規的藥品批準證明文件待領取信息,一致性評價9個,注射劑86個。
-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
