收藏 | 口溶膜處方工藝分析及溶出方法研究
《口溶膜臨床研究綜述》中總結了國內外已上市的口溶膜品種的臨床研究,本篇將針對口溶膜的處方、制備工藝、溶出方法進行總結,同時對口溶膜藥代動力學模型的建立提出相關建議。
口溶膜典型處方組成如下:原料藥:30%;水溶性成膜聚合物:40-50%;增塑劑:0-20%;填充劑、色素、矯味劑等等:0-40%。
原料藥:原料藥的粒徑或粒度分布及晶型的質量屬性將對制劑溶出速率造成影響,此外在口溶膜制備過程中,由于原料藥溶解性質可能會發生重結晶現象,制備過程中原料藥晶型檢測也非常重要。
水溶性成膜聚合物:水溶性成膜聚合物的性質將影響制劑的粘附性、崩解時限、載藥量及機械性能等質量特性,其材料性質的理解,有助于分析口溶膜劑型釋放特性,建立更具預測性藥代動力學模型。
目前在口溶膜處方中廣泛使用的水溶性成膜聚合物包括:纖維素類、淀粉類、半合成、合成的成膜聚合物等,其特性如下表所示:
水溶性成膜聚合物特性
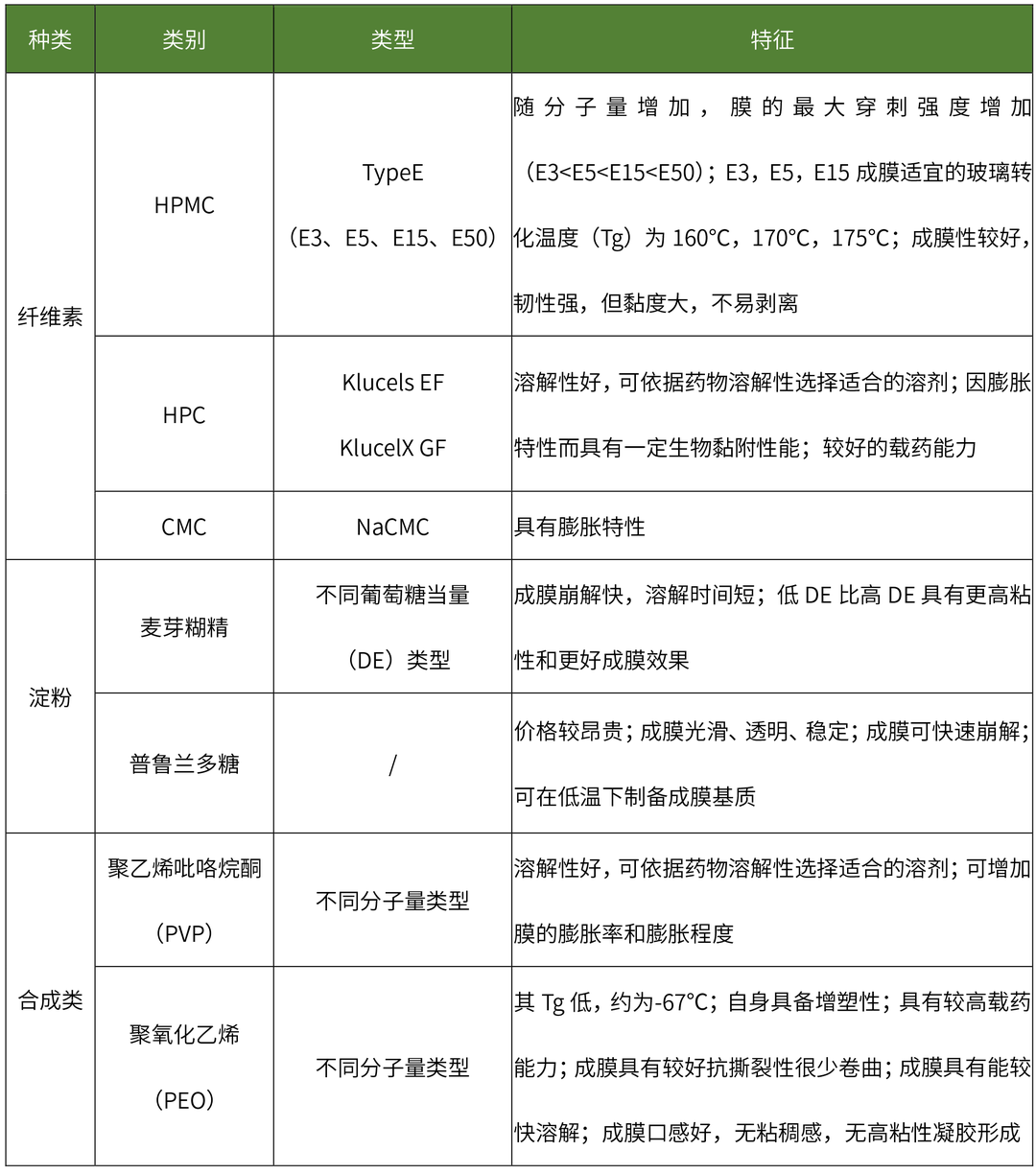
(點擊查看大圖)
不同類型成膜材料或不同比例成膜材料制備的口溶膜具有不同的釋放速率,利用藥代動力學模型對不同釋放速率的口溶膜進行藥代動力學參數進行分析,可更清晰理解成膜材料對體內外釋放影響的相關性。
增塑劑:增塑劑可與水溶性成膜聚合物相互作用,有利于膜劑的分裝和切割。常用的增塑劑有甘油、聚乙二醇(PEG400)、山梨醇、丙二醇等。有文獻報道增塑劑可能影響原料藥溶解度和藥物的吸收, 因此在處方研究也需關注增塑劑種類及用量的研究。
填充劑、色素、矯味劑等其他輔料:口溶膜口感是影響臨床受試者脫落的關鍵因素,也是口溶膜的關鍵質量屬性之一,甜味劑時常被用作膜劑中起矯味作用,經常被使用的甜味劑包括蔗糖、葡萄糖、糖精鈉、阿斯巴甜、三氯蔗糖等,其中三氯蔗糖由于其甜度高、安全性高、能量低,在各國的上市品種都包含;部分品種也會采用離子交換樹脂等掩味技術,掩蓋藥物苦味。 由于原料藥本身特性,如溶解性較差,穩定性不好,選擇在處方中添加表面活性劑或制備成納米混懸劑、環糊精包裹改善溶解性,或添加穩定劑改善品種穩定劑,改善原料藥溶解性輔料將極有可能影響藥物生物利用度,若臨床對照藥未采用相關輔料,則應謹慎選擇。
二、口溶膜工藝
膜劑的制備工藝包括傳統的溶劑澆鑄法和熱熔擠出法,也可應用新型的3D打印技術。
溶劑澆鑄法:溶劑澆鑄法是最常被運用的制備技術,其工藝過程簡單概況而言就是將成膜材料、原料藥和其他輔料溶解或懸浮在適宜的溶劑中,如水、乙醇、丙酮等;混合均勻后去除氣泡,然后澆鑄到模具上或涂布成膜劑,干燥后進行切割和包裝。
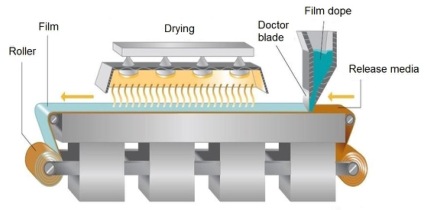
▲ 溶劑澆鑄法

▲ 涂布機
如果澆鑄混合溶液為混懸液或乳液,澆鑄過程中需關注其均勻性。分散顆粒大小不宜過大,如果顆粒粒徑大于250 μm,在工藝過程中可能會發生沉積,在膜表面形成劃痕。
干燥過程中需避免溶劑蒸發后在澆鑄溶液表面形成薄膜,阻礙溶劑的繼續蒸發,升高干燥溫度可使薄膜破裂,但反復形成薄膜后再破壞,將使最終形成的膜劑表面不均勻;干燥終點控制也非常重要,有機溶劑殘留量需控制在可接受限度內,水分殘留量可能會影響到膜劑的機械性能和穩定性。
熱熔擠出法:熔擠出法主要是難溶性藥物的膜制備技術,是將藥物、成膜材料及其他輔料混合物熔融擠壓通過模具,壓成膜,冷卻后切割,包裝。
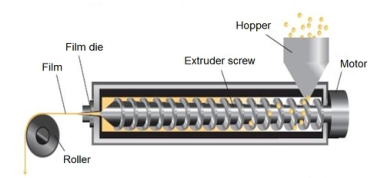
▲ 熱熔擠出法

▲ 熱熔擠出機
熱熔擠出工藝過程中可能出現擠出物膨脹現象,主要是由于成膜聚合物粘彈特性,在擠壓過程中受到高剪切和高能捏合導致,將影響最終膜劑的尺寸,可通過工藝參數調節解決該問題。
熱熔擠出工藝過程中原料藥在高溫、殘留水及殘留溶劑的作用下發生水解等化學反應,將影響最終膜劑的質量控制和穩定性;殘留水及殘留溶劑可通過輔料預處理盡可能控制,原料藥則需對熱穩定。
在高溫、壓力和強力混合下可能增加混合物中原料藥的溶解度,但溫度降低后,混合物中的原料藥可能會發生重結晶現象,可能影響最終膜劑的溶出,可選擇高粘度成膜材料解決。
打印技術:3D打印技術是將處方混合配制成打印漿液,通過計算機打印軟件導入口溶膜的三維模型,設置印刷參數進行打印制備,可以靈活的設計和準確的打印劑量為口溶膜個性化給藥提供一種新型制備方式;但3D打印技術需要選擇合適的打印基質,且載藥量較低,制備技術目前運用較少。
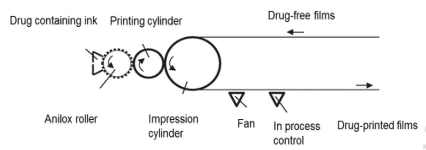
▲ 打印技術
溶出方法分析
目前國內外已上市口溶膜品種大多數溶出方法為槳法,溶出介質為水,介質體積為900 mL,未考慮舌的機械力,唾液流速,唾液體積小和唾液成分等口腔溶出的生理條件,此外口溶膜一般較輕,投到溶出介質中,極易漂浮在溶出介質表面影響溶出結果。
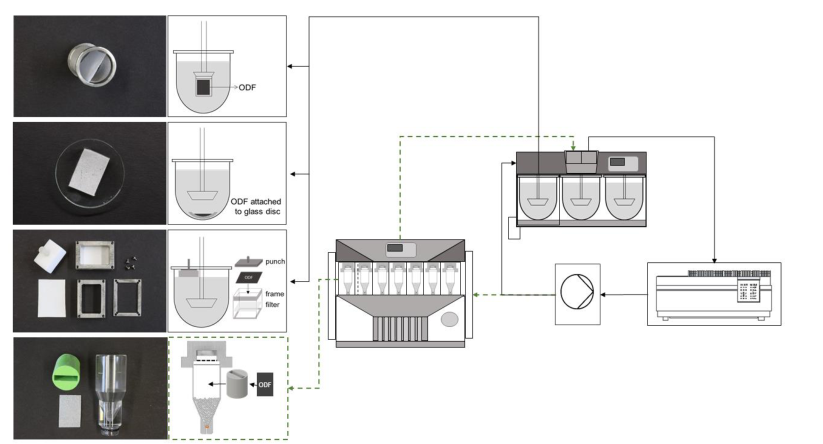
▲ 溶出方法
有文獻開發設計了更具有區分力的口溶膜溶出方法如:
由于口溶膜劑型特征為崩解迅速,厚度薄,重量輕,并且口腔中唾液體積小、唾液成分復雜,體內外相關性溶出方法建立困難,目前文獻報道區分溶出方法,尚未有校驗標準,不同設備之間檢測結果存在差異,無法判定方法的適宜性,未來仍需摸索建立口溶膜生物相關性溶出方法。
總結
通過對口腔生理條件以及口溶膜臨床研究、處方工藝、溶出方法的總結分析,口溶膜藥代動力學模型建立可能存在問題包括:
-
無法確認藥物在口腔中吸收的量;
-
影響藥物理化性質及制劑釋放特性的處方工藝因素較多;
-
體內外相關性溶出方法建立困難。
吡羅昔康原料藥溶解性較差,在pH1.8~pH5.4之間溶解度最低,且具有多晶型,不同晶型間的溶解性不同,口溶膜處方中成膜材料、pH調節劑、表面活性劑等均會影響吡羅昔康溶解性;Ahmed Abd EI-Bary等人[30]在建立吡羅昔康口溶膜藥代動力學模型時,為充分理解制劑釋放特性,除了溶出曲線的研究,還檢測了膜劑微環境的pH值,并采用光學顯微鏡和電子掃描顯微鏡,確定原料藥的粒徑以及在膜劑中分布的形態,通過藥代動力學模型的虛擬生物等效性試驗,確定了吡羅昔康口溶膜的最優處方。
在Fang chen等人的利培酮口溶膜PBPK藥代動力學模型的建立過程中發現利培酮口溶膜在水介質15min的溶出量是控制生物等效性風險的關鍵質量屬性。
藥代動力學模型的建立可有效提升制劑開發效率,降低臨床研究的風險,由于口溶膜劑型特征以及口腔中生理條件的特性,口溶膜藥代動力學模型建立面臨一定挑戰,在吡羅昔康口溶膜和利培酮口溶膜藥代動力學模型建立的文獻中可知,對藥物理化性質、劑型釋放特性的理解是建立符合預期藥代動力學模型的前提,雖然目前對口溶膜處方工藝的了解已較為充分,但影響藥物理化性質及制劑釋放特性的處方工藝因素仍需開發適宜的方法進行判定,且尚未有成熟的口溶膜生物相關性溶出方法,該方向的研究發展將極大提升口溶膜藥代動力模型預測的準確性,此外還需關注藥物在口腔中釋放吸收的量。
【參考文獻】
[1] ARUN A, AMRISH C, VIJAY S. Fast Dissolving Oral Films: An Innovative Drug Delivery System and Dosage Form [J]. Int. J. Chem Tech.2010,2(1):576-583.
[2] SIMON G, AMIT V, MARK S. Monitoring crystallisation of drugs from fast-dissolving oral films with isothermal calorimetry [J]. Int. J. Pharm. 2009.380 :105-111.
[3] ANA F B , CLAUDIA S , JORGE F J. Current status and future perspectives [J]. J. Control. Release. 2015, 206(28):1-19.
[4] 陳立, 王兵, 楊柳榴, 等. 奧氮平口溶膜的制備和體內外評價. [J]. 中國醫藥工業雜志, 2019,50( 7): 762-772.
[5] 張樺, 王棟海, 等. 利培酮口腔膜的制備及體內外評價[J].中國醫藥工業雜志, 2017,48( 3): 406-412.
[6] 朱麗丹,張麗妍.鹽酸氟西汀口溶膜的制備與質量評價[J].西北藥學志, 2020,35(6):889-893.
[7] 任連杰, 劉娟, 馬駿威等. 口腔膜劑的研發與評價[J]. 中國中藥雜志, 2017,42(19) : 3696-3702.
[8] SCOTT M. HARDIK V. MENG L, et al. Critical material attributes (CMAs) of strip films loaded with poorly watersoluble drug nanoparticles: I. Impact of plasticizer on film properties anddissolution[J]. Eur. J. Pharm. Sci. 2016,92(20):146-155.
[9] 陳芳, 張樺, 周臻, 等. 氫溴酸右美沙芬口溶膜的制備及體內外評價, 中國醫藥工業雜志, 2015, 46(9):964-969.
[10] 沈英, 黃雅菲, 俞平, 等. 阿立哌唑納米混懸劑口溶膜的制備與質量評價[J]. 西北藥學雜志, 2020,35(4):549-553.
[11] 張明會, 張勇, 王棟海, 等. 一種穩定的孟魯司特口腔薄膜劑. 中國, 104784157A [P]. 2015-07-22.
[12] BARNHART S, SLOBODA M. The future of dissolvable films [J]. Drug Deliv Technol. 2007,7(8):34-7.
[13] GOEL H, RAI P, RANA V, et al. Orally disintegrating systems: innovations in formulation and technology [J]. Recent Pat Drug Deliv Formul. 2008,2(3):258-74.
[14] RUSHIRAJ J, DASHARATH P. Hot melt extrusion: An industrially feasible approach for casting orodispersible film [J]. Asian J Pharm Sci, 2015, 10(4)292-305.
[15] 閆廷廷, 呂竹芬, 林威, 等. 半固態微擠出3D打印技術運用于個性化定制口腔速溶膜[J]. 中國新藥雜志, 2020,29( 8): 946-952.
[16] RAPHAEL K, DANIEL S, MIRIAM P, et al. A new biorelevant dissolution method for orodispersible films [J]. Eur. J. Pharm. Biopharm.2016,98:20-25.
[17] Yiran Xia, Fang Chen, Huiping Zhang, et al. A new method for evaluating the dissolution of orodispersible films [J]. Pharm. Dev. Technol.2015.20(3):375-379.
[18] Ahmed Abd El-Bary, Ibranhim Al Sharabi , Balqees Saeed Hzaz’a. Effect of casting solvent, film forming agent and solubilizer on orodispersible films of a polymorphic poorly soluble drug: An in vitro/in silico study [J]. Drug Dev.ind.Pharm. 2019,45(11):1751-1769.
[19] Fang Chen, Hongrui Liu, Bing Wang, et al. Evaluation of the Impacts of Formulation Parameters on the Pharmacokinetics and Bioequivalence of Risperidone Orodispersible Film: a Physiologically Based Pharmacokinetic Modeling Approach. AAPS Pharm Sci Tech. 2020,21(7),245.
-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
