收藏 | 口溶膜臨床研究綜述
口溶膜作為一種新型口服藥物遞送劑型,具有可在口腔中迅速崩解,厚度薄,重量輕,耐折抗拉,攜帶方便,劑量準(zhǔn)確等優(yōu)點(diǎn),可克服口腔崩解片易碎、抗折性差及口服液體制劑劑量控制差的缺點(diǎn),有效的解決特殊患者如兒童、老人、精神病患者等服用藥物順應(yīng)性差的問題,因此受到了廣泛關(guān)注,是制藥企業(yè)選擇改良創(chuàng)新藥物研究的熱點(diǎn)劑型。
臨床研究是改良創(chuàng)新藥研究成功與否的關(guān)鍵,在臨床試驗(yàn)開展前利用軟件建立藥代動(dòng)力學(xué)模型,預(yù)測藥代動(dòng)力學(xué)參數(shù)Cmax,AUC0-t,AUC0-inf,并與參照藥進(jìn)行虛擬生物等效性試驗(yàn)(BE),可有效評(píng)估臨床研究風(fēng)險(xiǎn)。
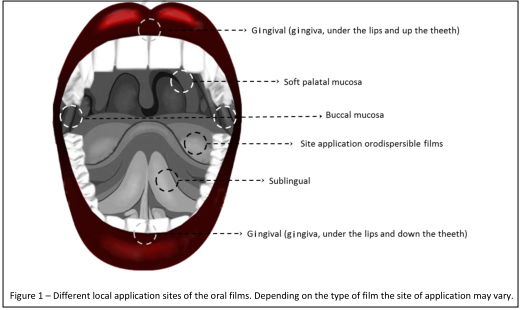
藥代動(dòng)力學(xué)模型建立需充分理解藥物理化性質(zhì),劑型釋放特點(diǎn),藥物吸收部位等因素。口腔黏膜下有大量的毛細(xì)血管匯總到頸內(nèi)靜脈,藥物經(jīng)口腔黏膜吸收后,能避免肝臟首過效應(yīng),提高生物利用度,口腔黏膜藥代動(dòng)力學(xué)模型的建立首先需理解藥物經(jīng)由口腔黏膜吸收的量。口溶膜劑型的釋放特點(diǎn)是在口腔中迅速崩解釋放,而口腔腔道中唾液體積小,唾液組成包含鈣、鉀、鈉等離子鹽,pH值約為6.8,口溶膜在口腔中崩解后,藥物在唾液中存在的形式未知,且口腔黏膜包括頰粘膜、舌下黏膜、硬腭黏膜和牙齦黏膜,不同口腔黏膜之間由于上皮細(xì)胞面積、角質(zhì)層與非角質(zhì)層組織厚度及組成等生理特征不同,對(duì)藥物滲透性也不同,其滲透順序?yàn)椋荷嘞吗つぃ绢a粘膜>硬腭黏膜,藥物接觸的黏膜類型及接觸時(shí)間也將影響藥物經(jīng)由口腔黏膜吸收的量,由此口溶膜藥代動(dòng)力學(xué)模型的建立面臨一定挑戰(zhàn)。本文總結(jié)了國內(nèi)外已上市的口溶膜品種的臨床研究。
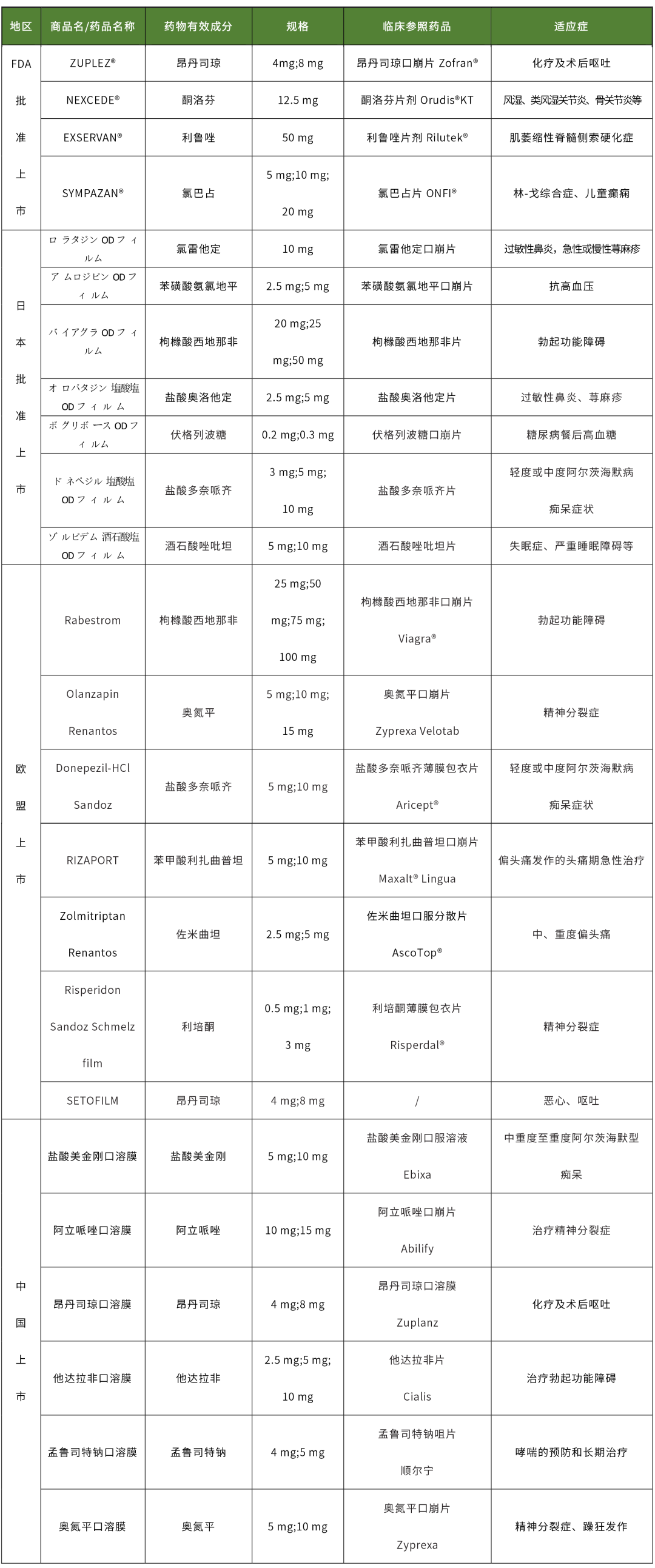
由上表可知,國內(nèi)外已上市口溶膜的臨床參照藥劑型大多數(shù)都為片劑,其中口崩片居多,薄膜包衣片極少,僅中國上市的鹽酸美金剛口溶膜,選擇口服溶液作為臨床參照藥。由劑型釋放特點(diǎn)分析,通常情況下薄膜包衣片釋放速率慢于口溶膜,口服溶液快于口溶膜,口崩片與口溶膜釋放相似,由此選擇口崩片作為臨床參照藥有利于生物等效性研究;但考慮到口溶膜需進(jìn)行餐后生物等效性研究,不同劑型餐后的胃排空時(shí)間不同,與片劑相比口服溶液和口溶膜餐后的胃排空時(shí)間相近,因此選擇口服溶液作為臨床參照藥也存在一定優(yōu)勢。
口溶膜厚度薄,重量輕,在口腔中崩解迅速,臨床試驗(yàn)受試者在服用吞服過程中敏感度低,存在未吞服或吞服不完全的情況,臨床試驗(yàn)設(shè)計(jì)過程中需關(guān)注相關(guān)細(xì)節(jié)的設(shè)計(jì),F(xiàn)DA批準(zhǔn)上市的昂丹司瓊口溶膜在臨床研究中比較了其與參照藥(口崩片)在口腔中崩解或溶出時(shí)間,為臨床研究服藥吞咽時(shí)間制定提供了依據(jù),此外FDA已批準(zhǔn)上市的氯巴占口溶膜在臨床試驗(yàn)中,要求臨床研究人員將膜劑放置在受試者舌頭中央,要求受試者用舌頭在上顎輕輕摩擦薄膜,以促進(jìn)薄膜融化和消失。
對(duì)于多規(guī)格品種FDA、EMA及CDE均可允許基于臨床試驗(yàn)規(guī)格進(jìn)行其他規(guī)格生物等效性試驗(yàn)的豁免,參考CDE頒布的《以藥動(dòng)學(xué)參數(shù)為終點(diǎn)評(píng)價(jià)指標(biāo)的化學(xué)藥物仿制人體生物等效性研究技術(shù)指導(dǎo)原則》中常釋制劑片劑、膠囊劑的多規(guī)格生物等性試驗(yàn)要求內(nèi)容,口溶膜也應(yīng)需滿足各規(guī)格制劑在不同pH介質(zhì)中體外溶出曲線相似及處方比例相似的要求,才能豁免其他規(guī)格制劑的生物等性試驗(yàn)。
【參考文獻(xiàn)】
[1] European Pharmacopoeia [S]. EP 11.0: 987.
[2] 國家藥典委員會(huì). 中華人民共和國藥典[S]. 2020年版. 四部. 北京:中國醫(yī)藥科技出版社, 2020:24.
[3] 美國藥典[S]. USP 2021: general chapter <1151> PHARMACEUTICAL DOSAGE FROMS.
[4] 江卓芩, 江昌照, 葉金翠, 等. 口腔膜劑的研究進(jìn)展及市售藥物概述[J]. 中國新藥雜志, 2020,29(6):634-641.
[5] 陳芳, 夏怡然, 侯惠民. 口腔膜劑的研發(fā)及應(yīng)用[J]. 中國醫(yī)藥工業(yè)雜志, 2012,43(6): 484-489.
[6] 陳立, 陳芳. 膜劑的研究和應(yīng)用進(jìn)展[J]. 中國醫(yī)藥工業(yè)雜志, 2018, 49(5):557-563.
[7] 李丁,王健,侯惠民. 口腔黏膜給藥系統(tǒng)研究進(jìn)展[J]. 中國醫(yī)藥工業(yè)雜志, 2009, 40(4):303-307.[8]FDA U.S. Food and Drug Administration. Quality Attribute Considerations for Chewable Tablets Guidance for industry[EB/OL]. https://www.fda.gov/media/98598/download
[9] 謝燕, 袁秀榮, 李國文. 口腔給藥系統(tǒng)研究進(jìn)展及其在中醫(yī)藥中的應(yīng)用[J]. 上海中醫(yī)藥雜志, 2007, 41(10) :83-86.
[10] Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations [EB /OL]. [2022-09-28]. https: / /www. accessdata. fda. gov /scripts /cder /ob /.
[11] Pharmaceuticals and Medical Devices Agency[EB /OL].[2022-09-28]. http: / /pmda. go. jp /search_index. Html.
[12] Heads of Medicines Agencies MRI Product Index [EB /OL]. [2022-09-28]. http: / /mri. cts-mrp. eu /Human. Pharmaceuticals and Medical Devices Agencyhttp: / /pmda. go. jp /search_index. Html.
[13] 國家藥品監(jiān)督管理局藥品審評(píng)中心. [EB /OL]. http://www.chinadrugtrials.org.cn/index.html.
[14] FDA U.S. Food and Drug Administration. Zuplenz (Ondansetron) [EB/OL]. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2010/022524Orig1s000ClinPharmR.pdf
[15] FDA U.S. Food and Drug Administration. Sympazan (Clobazam) [EB/OL]. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2018/210833Orig1s000ClinPharmR.pdf
[16] 國家藥品監(jiān)督管理局藥品審評(píng)中心.《以藥動(dòng)學(xué)參數(shù)為終點(diǎn)評(píng)價(jià)指標(biāo)的化學(xué)藥物仿制人體生物等效性研究技術(shù)指導(dǎo)原則》. [EB/OL]. [2016-03-08]. https://www.cde.org.cn/zdyz/downloadAttidCODE=c243e8396e2b86e62de37f3d3e494f2e.
-END-


轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-61006450
Hotline服務(wù)熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場部:
技術(shù)市場部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
