政策法規(guī)||藥物非臨床研究質(zhì)量管理規(guī)范認(rèn)證管理辦法(附法規(guī)概覽01.28-02.03)
01
國(guó)家藥監(jiān)局關(guān)于發(fā)布《藥物非臨床研究質(zhì)量管理規(guī)范認(rèn)證管理辦法》的公告(2023年第15號(hào))
長(zhǎng)按識(shí)別圖中二維碼
查看詳細(xì)信息

02
關(guān)于適用《Q3D(R2):元素雜質(zhì)》《M10:生物分析方法驗(yàn)證及樣品分析》國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)指導(dǎo)原則的公告(2023年第16號(hào))

長(zhǎng)按識(shí)別圖中二維碼
查看詳細(xì)信息

03
國(guó)家藥監(jiān)局關(guān)于發(fā)布仿制藥參比制劑目錄 (第六十四批)的通告(2023年第6號(hào))
長(zhǎng)按識(shí)別圖中二維碼
查看詳細(xì)信息

01
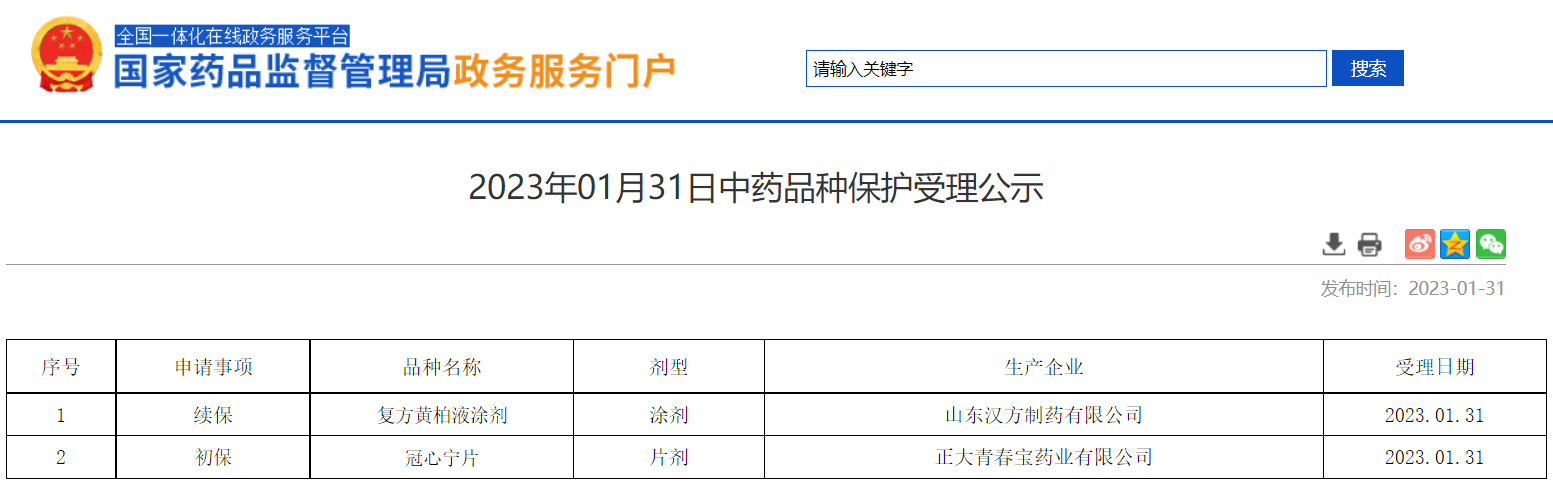
2023年01月31日中藥品種保護(hù)受理公示
長(zhǎng)按識(shí)別圖中二維碼
查看詳細(xì)信息

02
國(guó)家藥監(jiān)局關(guān)于發(fā)布YY/T 1888-2023《重組人源化膠原蛋白》醫(yī)療器械行業(yè)標(biāo)準(zhǔn)的公告 (2023年第14號(hào))
長(zhǎng)按識(shí)別圖中二維碼
查看詳細(xì)信息

03
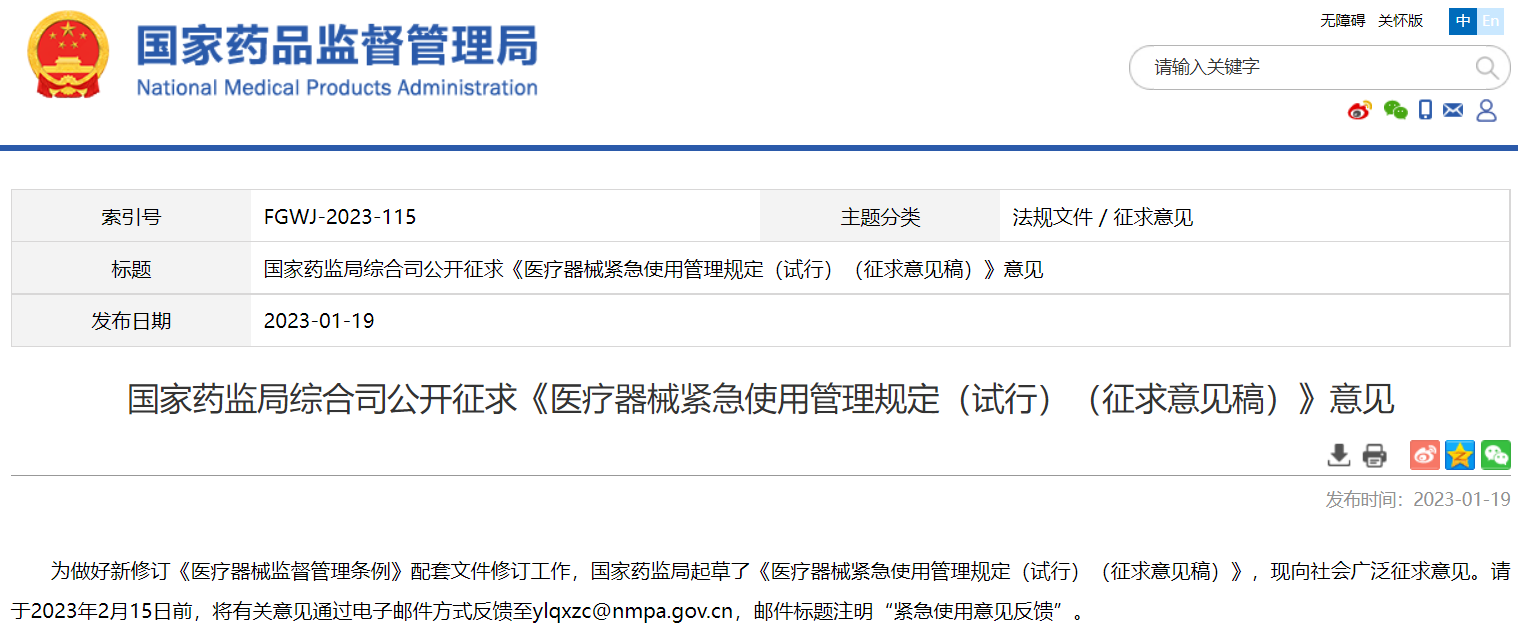
國(guó)家藥監(jiān)局綜合司公開征求《醫(yī)療器械緊急使用管理規(guī)定(試行)(征求意見稿)》意見
長(zhǎng)按識(shí)別圖中二維碼
查看詳細(xì)信息

04
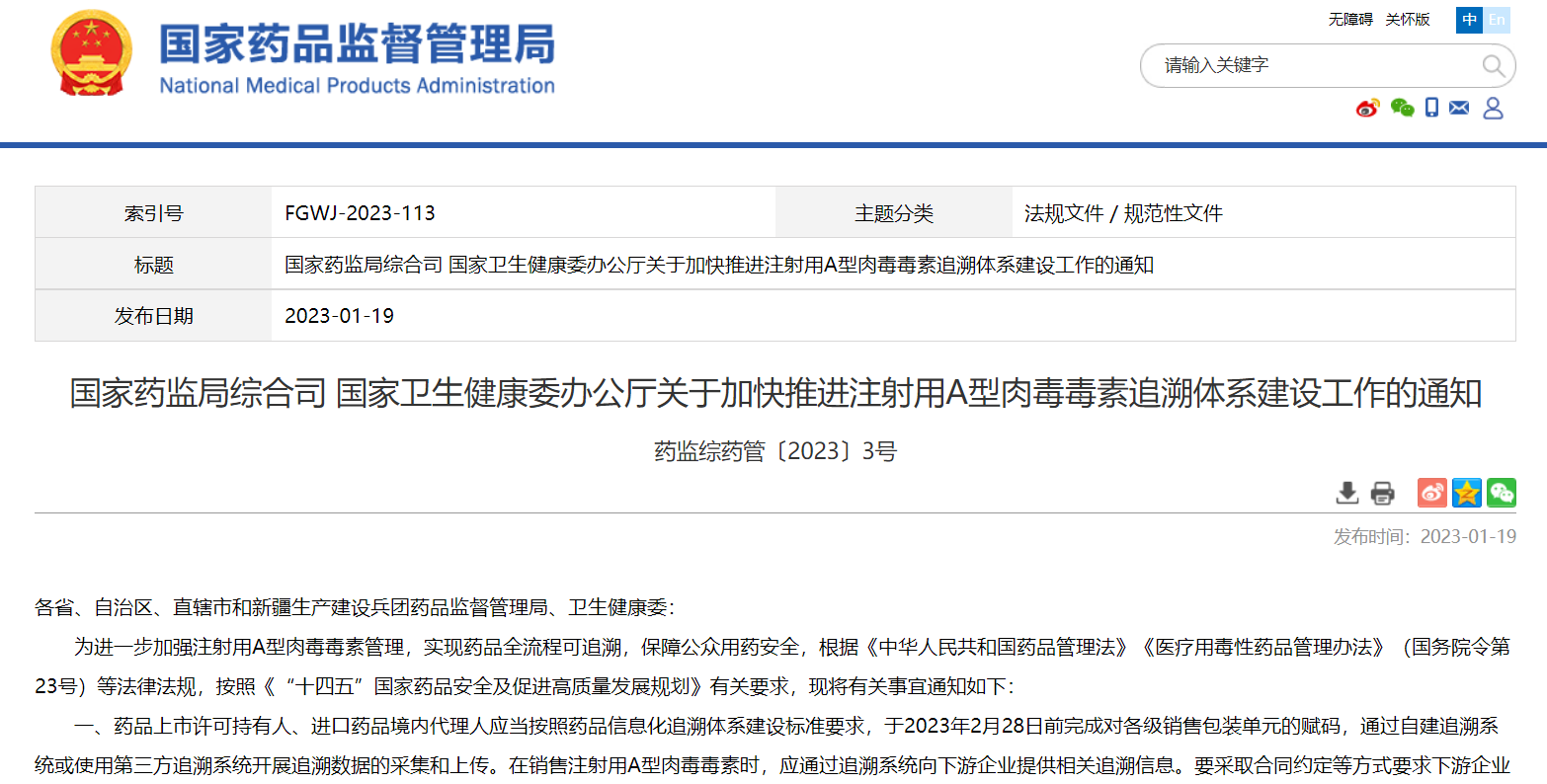
國(guó)家藥監(jiān)局綜合司 國(guó)家衛(wèi)生健康委辦公廳關(guān)于加快推進(jìn)注射用A型肉毒毒素追溯體系建設(shè)工作的通知
長(zhǎng)按識(shí)別圖中二維碼
查看詳細(xì)信息

01
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《慢性淋巴細(xì)胞白血病新藥臨床研發(fā)技術(shù)指導(dǎo)原則》的通告(2023年第1號(hào))

長(zhǎng)按識(shí)別圖中二維碼
查看詳細(xì)信息

02
關(guān)于公開征求《eCTD實(shí)施指南V1.1(征求意見稿)》及《eCTD驗(yàn)證標(biāo)準(zhǔn)V1.1(征求意見稿)》意見的通知

長(zhǎng)按識(shí)別圖中二維碼
查看詳細(xì)信息

03
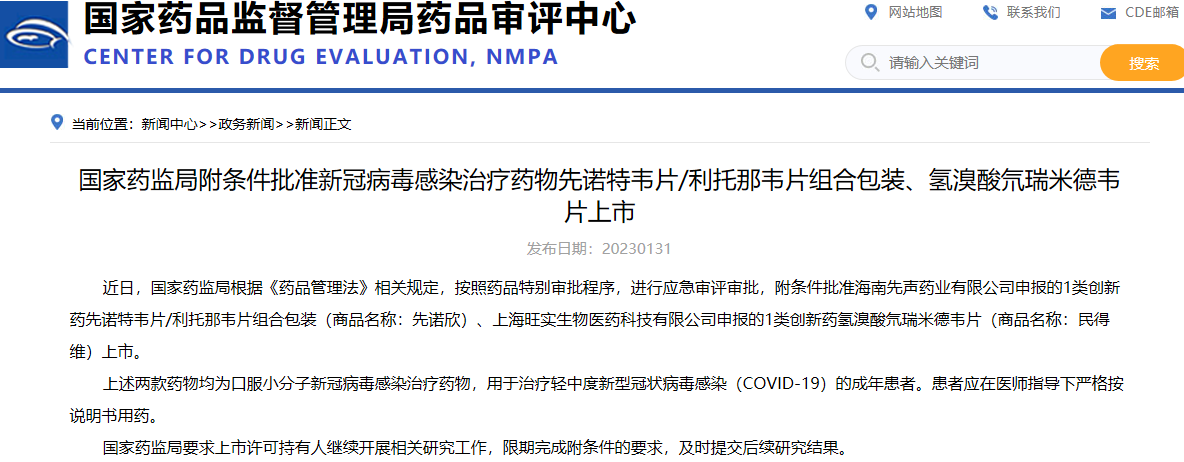
國(guó)家藥監(jiān)局附條件批準(zhǔn)新冠病毒感染治療藥物先諾特韋片/利托那韋片組合包裝、氫溴酸氘瑞米德韋片上市
長(zhǎng)按識(shí)別圖中二維碼
查看詳細(xì)信息

關(guān)于公開征求ICH指導(dǎo)原則《Q9(R1):質(zhì)量風(fēng)險(xiǎn)管理》中文翻譯稿意見的通知

長(zhǎng)按識(shí)別圖中二維碼
查看詳細(xì)信息

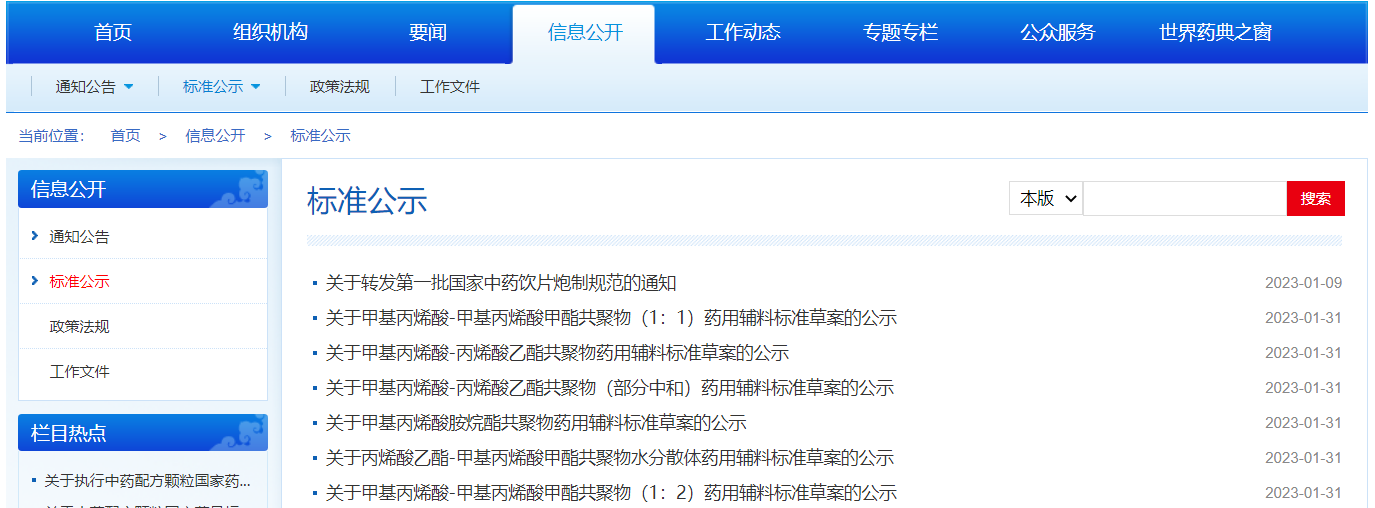
發(fā)布6個(gè)品種的國(guó)家藥品標(biāo)準(zhǔn)草案的公示,3個(gè)品種的國(guó)家藥品標(biāo)準(zhǔn)草案,6種檢測(cè)方法的修訂草案的公式。
掃描識(shí)別圖中二維碼
查看詳細(xì)信息

-END-



轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-61006450
Hotline服務(wù)熱線:010-61006450
 簡(jiǎn)體中文
簡(jiǎn)體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場(chǎng)部:
技術(shù)市場(chǎng)部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
