匯總 | 臨床及上市后藥物安全性報告要求(附報告概述對比圖)
臨床試驗期間
臨床試驗期間的報告主要分為兩類,研發期間安全性更新報告(DSUR)和藥物臨床試驗期間安全性數據快速報告。其中,藥物臨床試驗期間安全性數據快速報告主要包括非預期且嚴重的不良反應的快速報告(SUSAR快速報告)、及其他潛在嚴重安全性風險信息快速報告。
DSUR:
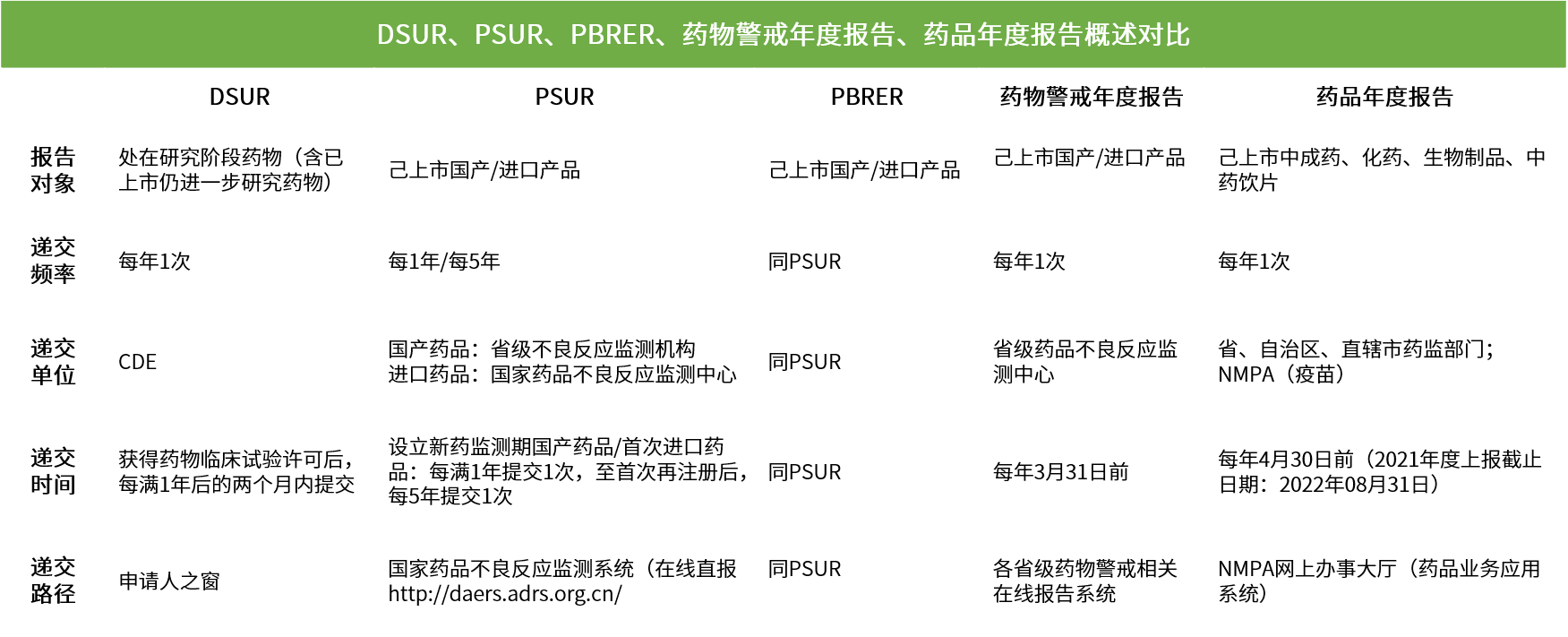
申辦者應當定期在藥品審評中心網站提交DSUR。DSUR應當每年提交一次,于藥物臨床試驗獲準后每滿一年后的兩個月內提交。藥品審評中心可以根據審查情況,要求申辦者調整報告周期。
-
DSUR的準備、撰寫與提交,參照“ICH-E2F”及《研發期間安全性更新報告管理規范(試行)》。
-
國家藥品監督管理局藥品審評中心通告2020年第7號,要求《化學藥IND申請藥學研究年度報告(試行)》與研發期間安全性更新報告統一,不再單獨提交。
自2018年5月1日起,藥物臨床研究期間報告SUSAR適用《E2A:臨床安全數據的管理:快速報告的定義和標準》和《E2B(R3):臨床安全數據的管理:個例安全報告傳輸的數據元素》。2018年5月1日后開始實施的臨床試驗,按照《藥物臨床試驗期間安全性數據快速報告的標準和程序》執行。
SUSAR快速報告提交途徑:
-
GATEWAY方式提交:申請人申請GATEWAY賬號并進行電子傳輸測試,測試成功后,正式提交。
-
XML文件方式提交:申請人登陸國家藥品審評中心網站,在“申請人之窗”注冊賬號,在左側菜單欄下的“藥物警戒提交”提交XML格式文件。
其他潛在的嚴重安全性風險信息包括:明顯影響藥品風險/獲益評估的信息;可能導致藥品用法用量改變;影響藥品總體研發進展。如:新近完成的動物實驗中的重大安全性發現。
提交途徑:
-
方式一:申請人之窗“研發期間安全性相關報告遞交”;
-
方式二:發送電子郵件至:lcqjywjj@cde.org.cn。
藥品上市后報告
藥品上市后報告主要分為四類,定期安全性更新報告(PSUR)、定期獲益-風險評估報告(PBRER)、藥物警戒年度報告和藥品年度報告。

PSUR的主要目的是全面了解經批準的藥品的安全性。
PBRER的主要目的是對藥品風險和批準適應癥的獲益中新的或新出現的信息進行全面、簡明和重點分析。
ICH觀點:鑒于對一個藥品的獲益考慮進行風險評估是最有意義的,特別是當風險估計發生重要變化時,PBRER將比PSUR更為重視獲益。PBRER、藥物開發安全性更新報告(DSUR,ICH E2F)和風險管理計劃(ICH E2E)中的安全性規范的相應章節內容可以相同。
2019年11月29日,國家藥品不良反應監測中心組織并發布《藥品上市許可持有人藥物警戒年度報告撰寫指南(試行)》。旨在規范持有人撰寫藥物警戒年度報告,總結藥物警戒體系建設、藥品風險評估和控制等,落實持有人全生命周期主體責任。
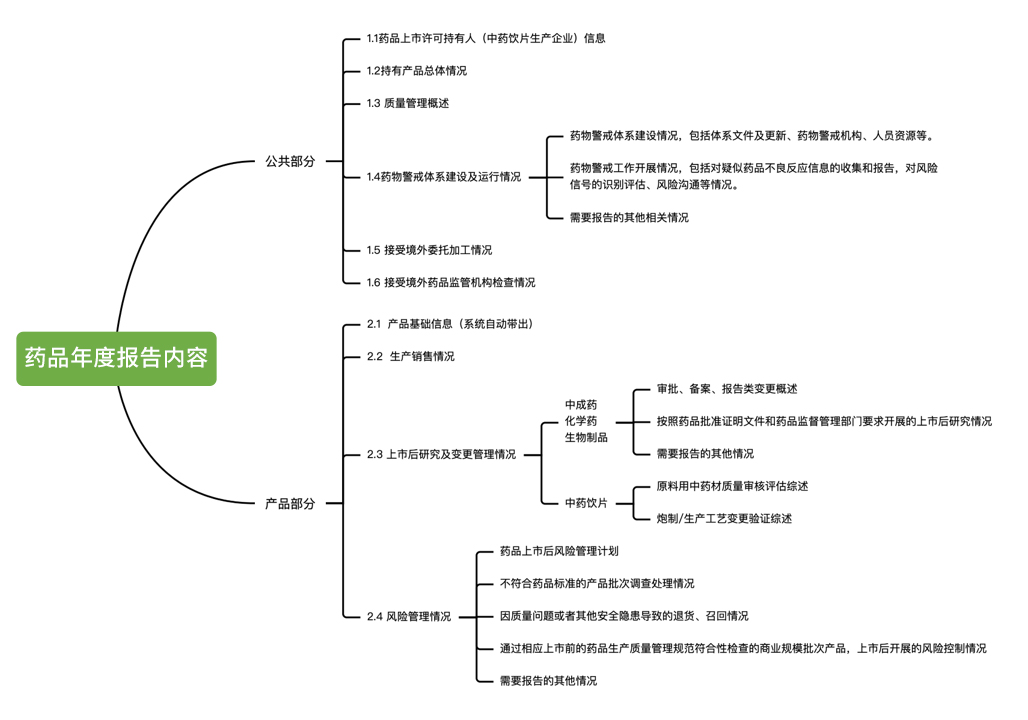
藥物警戒年度報告主要分為10部分,包括持有人信息、藥品信息、藥物警戒體系、各例藥品不良反應報告、定期分析評估、風險評估和控制、上市后安全性研究、藥物警戒工作自評、其他說明及附件列表。
2022年4月12日,國家藥監局組織制定《藥品年度報告管理規定》(國藥監藥管[2022]16號),同時,為保障藥品年度報告制度的落地實施,國家藥監局建設了藥品年度報告采集模塊,同期啟用。
-END-



轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
