探討 | 改良型新藥的臨床試驗進展及開發思路
前言 改良型新藥臨床試驗
2020年CDE發布《化學藥品改良型新藥臨床試驗技術指導原則》。
·與全新靶點和結構的創新藥相比,改良型新藥具有更多可借鑒的已知活性成分藥品的研究數據,可縮短臨床研發的周期。
·改良型新藥需要立足于明確的臨床需求,能夠體現顯著的臨床優勢即患者未被滿足的臨床需求。新藥或新的治療手段可顯著提高療效;或在不降低療效的同時,顯著降低當前用藥患者的不良反應或用藥的相關風險;或顯著提高患者的依從性。
在改良型新藥中,2.2類藥物相對簡單。
·該類藥物不改變原料藥的藥理活性,主要通過新劑型或新工藝的改進,體現產品的臨床優勢,具有明確的開發目標。
·該類藥物因活性成分未變化,一些非臨床和臨床數據可以與已上市劑型進行橋接。資金投入的風險較低、成本也相應較低。
針對該指導原則,結合上述2.2類改良型新藥的特點,此類藥物針對特殊人群的新劑型獲批的概率較大。如具有精神障礙的病人、阿爾茲海默癥患者、嬰兒和兒童等特殊患者,研發人員可以考慮將口服的片劑或膠囊劑改劑型為更容易服用的口崩片、口溶膜或皮膚外用貼劑,以達到提高患者的順應性的目的。
目前國內2.2類改良型新藥,如已上市的奧氮平口溶膜、孟魯司特鈉口溶膜,臨床評價方式均為與已上市的劑型開展生物等效性研究(BE試驗)。
本文章以托法替布緩釋片和托吡酯緩釋膠囊為案例,講述兩種緩釋制劑臨床試驗,以及對改良型新藥臨床開展的啟示。
托法替布片為首個作用機制的JAK通路抑制劑,是治療類風濕關節炎疾病的藥物。該藥物最初上市劑型為片劑,隨后緩釋片上市。
托法替布緩釋片臨床研究過程中,并未開展驗證性臨床,而是將速釋制劑的數據進行巧妙橋接,豁免驗證性臨床試驗。托法替布緩釋片臨床研究如下:
·單劑量研究中(服用1天),托法替布緩釋片11mg(qd)與托法替布片5mg(bid),開展BE試驗。
·多劑量研究中(連續服用5天),托法替布緩釋片11mg(qd)與托法替布片5mg(bid),開展BE試驗。
結果如下:
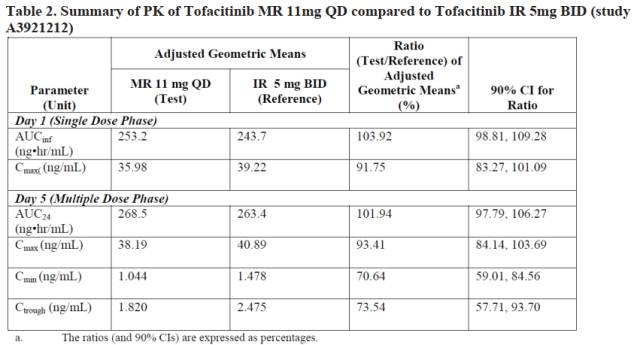
圖1:托法替布速釋片與緩釋片生物等效性結果
(單劑量和多劑量)
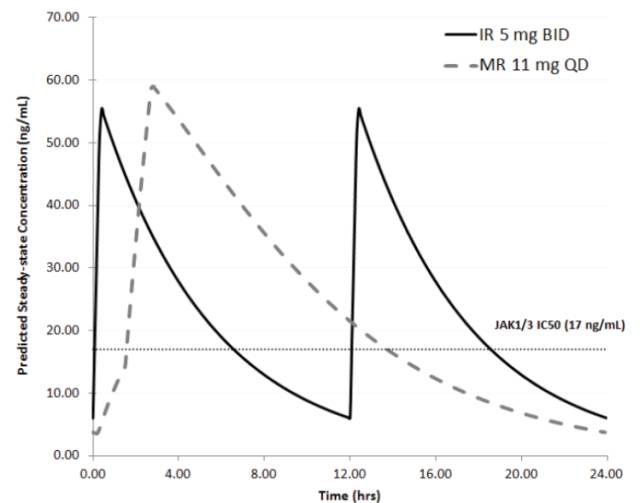
圖2:托法替布速釋片與緩釋片PK曲線
·單劑量試驗中,兩個劑型PK參數,Cmax和AUC值90%置信區間在80.00%-125.00%之間,滿足生物等效的標準。
·多劑量試驗中,兩個劑型PK參數中,Cmax和AUC值生物等效,但是Cmin和Ctrough值,緩釋制劑偏慢,不滿足生物等效性標準。
多劑量試驗中,穩態狀態下,緩釋制劑的Cmin和Ctrough值與速釋制劑生物不等效,Cmin值較緩釋制劑低約29%,Ctrough值低約26%。
為驗證Cmin和Ctrough值對于藥效影響,列舉了速釋制劑的PK/PD研究結果,不同規格制劑的PK和PD的研究如下表:
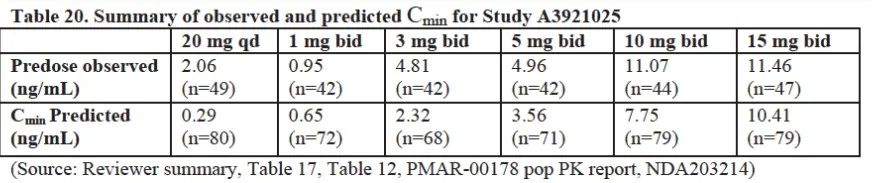
圖3:不同規格制劑PK結果
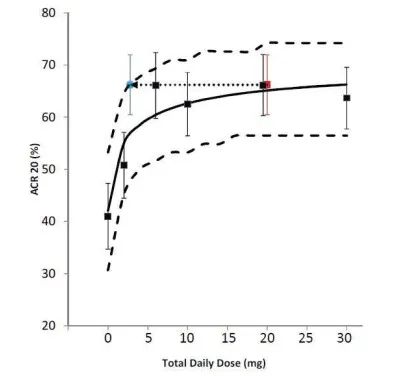
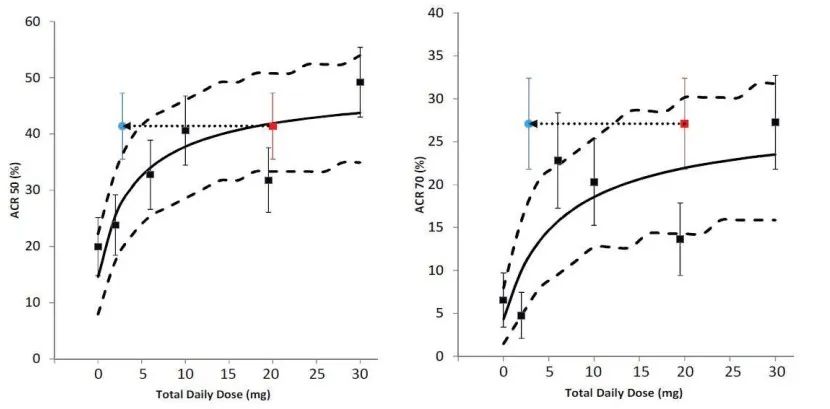
圖4:不同規格制劑PD結果
結論
本品種PD研究中以美國風濕病學會(ACR)規定觀指標,若患者達到20%、50%或70%的緩解,即達到ACR20、ACR50或ACR70緩解。
上述結果,美國風濕協會認為20mg(qd)和10mg(bid)的療效一致。而兩者的PK參數中Cmin值降低7倍(約為86%),該值遠遠大于緩釋制劑11mg(qd)和速釋制劑5mg(bid)的差異(降低約29%)。因此緩釋制劑和速釋制劑雖Cmin和Ctrough值有差異,但并不影響的藥效,兩種制劑的藥效一致。
托法替布緩釋制劑臨床試驗中開展了食物對于藥物吸收的影響,利用不同制劑釋放的溶出與PK的關系建立IVIVC模型,確定溶出的標準。基于上述的臨床試驗研究,本品種的緩釋制劑未開展驗證性臨床。
緩釋制劑臨床研究中,與速釋制劑開展生物等效性試驗,結果如下:

圖5:速釋制劑與緩釋制劑PK曲線
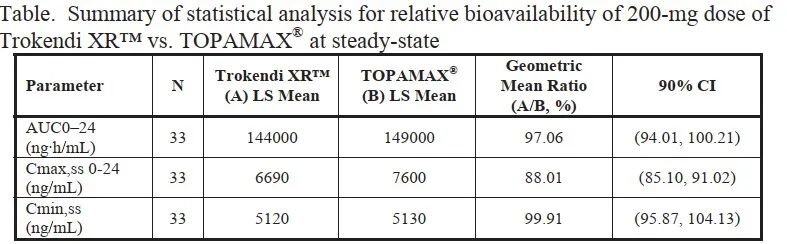
圖6:速釋制劑與緩釋制劑PK參數
速釋制劑與緩釋制劑PK參數相比,Cmax,ss值、Cmin,ss值和AUC0-24值的90%置信區間均在80.00%-125.00%之間,兩種制劑生物等效。
除此之外,該試驗中也分析了不同時間段,兩種制劑藥動學的差異,如圖所示:
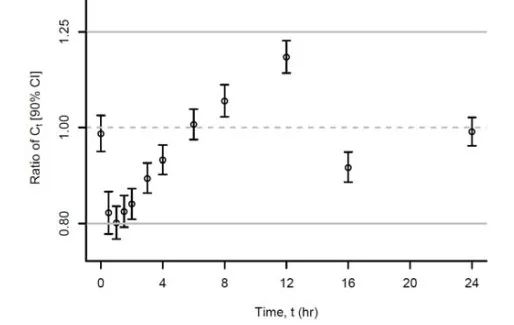
圖7:速釋制劑和緩釋制劑Ct值的生物等效性
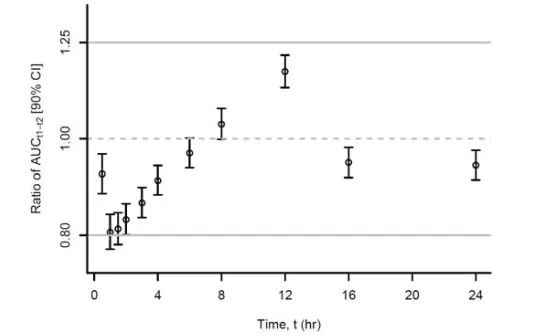
圖8:速釋制劑和緩釋制劑AUCt值的生物等效性
兩種不同劑型,對比了不同時間段的PK差異,幾乎全部數據均在80.00%-125.00%之間。受試者服用過程中,兩種劑型藥動學一致。
緩釋制劑上市規格較多,臨床試驗過程中,也對比了不同規格制劑的PK,如下圖所示:
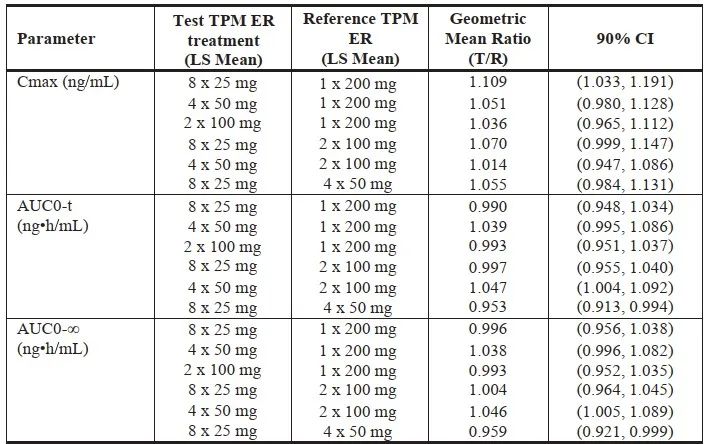
圖9:托吡酯緩釋膠囊不同規格的PK參數
緩釋膠囊為小丸組成,試驗中對比膠囊與膠囊內容物+蘋果醬的等效性試驗,如下表:
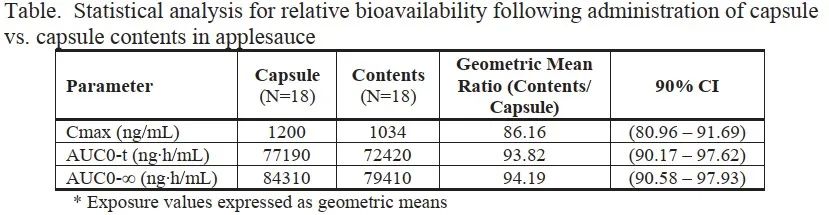
圖10:不同服用方式PK參數
數據表明兩種服藥方式生物等效,表明該膠囊服用時可去掉囊殼,膠囊內容物與軟性食物一同服用。
托吡酯緩釋膠囊臨床試驗中開展了食物對于藥物吸收的影響,但并未建立IVIVC模型,溶出標準是根據一年內商業批樣品的溶出情況進行制定。基于緩釋制劑與速釋制劑生物等效性,并在每個時間段均為生物等效,因此該緩釋制劑劑型未開展驗證性臨床。
托法替布緩釋片和托吡酯緩釋膠囊是緩釋劑型中豁免驗證性臨床的代表:
·托法替布緩釋片巧妙地與速釋片劑數據進行橋接,證明緩釋制劑的有效性;
·托吡酯緩釋膠囊將每個時間段的藥動學參數與片劑進行比較,證明兩種制劑的差異較小。實現豁免驗證性臨床。
在開發改良型新藥尤其改劑型品種時,企業往往希望采用較少的臨床試驗,證明與已上市劑型無差異。基于上述兩個品種豁免驗證性臨床案例,給我們改良新藥物的臨床試驗提供新的思路。
·2.2類改良新藥物中最為常用的評價方法,即與已上市劑型開展生物等效性研究(BE試驗)。
·基于劑型、藥物性質和吸收的特點,改良型藥物與已上市品種,生物等效性較為困難。而改良型新藥具有很高的臨床價值,我們能否考慮采用藥效(PD)的方式評價兩種劑型的差異。
·基于不同劑型特點,改劑型與已上市的劑型,并不是所有的PK參數均滿足生物等效性標準,我們能否考慮采用PK/PD的模型,證明兩種劑型的有效性。
參考文獻:
《化學藥品改良型新藥臨床試驗技術指導原則》
《Xeljanz (tofacitinib) Extended Release (XR) Tablets》
《Drug Approval Package》
以上為筆者的個人思考,歡迎大家進行交流。
-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
