收藏!中藥品種保護和注冊申報流程詳解
為提高中藥品種質量,保護中藥生產企業合法利益,對質量穩定、療效確切的中藥品種實行分級保護。受保護的中藥品種,必須是列入國家藥品標準的品種。經國務院衛生行政部門認定,列為省、自治區、直轄市藥品標準的品種,也可以申請保護。
中藥保護品種申請辦理基本流程

中藥品種的保護期限
根據《中藥品種保護條例》,國家對受保護的中藥品種劃分一級和二級。中藥一級保護品種分別為三十年、二十年、十年;中藥二級保護品種為七年。

-
中藥一級保護品種因特殊情況需要延長保護期限的,延長的保護期限由國務院衛生行政部門根據國家中藥品種保護審評委員會的審評結果確定;但是,每次延長的保護期限不得超過第一次批準的保護期限。
-
中藥二級保護品種在保護期滿后可以延長七年。
02 中藥注冊發展及要求
政策沿革
1963年 《關于藥政管理的若干規定》
首次明確了藥品的定義、審批程序、臨床研究、生產審批及審批的藥品范圍。
1985年 《新藥審批辦法》
首次將新藥分成中藥、西藥和生物制品三大類別,明確了新藥的定義(我國未生產的藥品)。
1999年 《新藥審批辦法》
將新的中藥復方制劑亦按新藥管理。該辦法將中藥分為五個大類,增加了中藥注射劑、有效成分、復方有效部位群等小類,將新增主治病證的藥品列為第五大類。
2007年 《藥品注冊管理辦法》(2007版)
將中藥細化為9個注冊類別,1-6類為新藥,7類、8類為改變給藥途徑和改劑型品種,9類為仿制藥。
明確了中藥復方制劑注冊申報的相關要求。
2020年 《藥品注冊管理辦法》(2020年版)
分為創新藥、改良型新藥、古代經典名方復方制劑、同名同方等。
中藥注冊主要分為中藥創新藥、中藥改良型新藥、古代經典名方重要復方制劑、同名同方藥及其他在境外已上市境內未上市的中藥、天然藥物制劑。
中藥創新藥指處方未在國家藥品標準、藥品注冊標準及國家中醫藥主管部門發布的《古代經典名方目錄》中收載,具有臨床價值,且未在境外上市的中藥新處方制劑。主要涵蓋中藥復方制劑、新藥材及其制劑、從單一植物、動物、礦物等物質中提取得到的提取物及其制劑。
-
中藥復方制劑系指由多味飲片、提取物等在中醫藥理論指導下組方而成的制劑。
-
新藥材及其制劑系指即未被國家藥品標準、藥品注冊標準以及省、自治區、直轄市藥材標準收載的藥材及其制劑,以及具有上述標準藥材的原動、植物新的藥用部位及其制劑。
中藥改良型新藥指改變已上市中藥的給藥途徑、劑型,且具有臨床應用優勢和特點,或增加功能主治等的制劑。一般包含以下情形:
-
改變已上市中藥給藥途徑的制劑,即不同給藥途徑或不同吸收部位之間相互改變的制劑。
-
改變已上市中藥劑型的制劑,即在給藥途徑不變的情況下改變劑型的制劑。
-
中藥增加功能主治。
-
已上市中藥生產工藝或輔料等改變引起藥用物質基礎或藥物吸收、利用明顯改變的。
古代經典名方中藥復方制劑是指來源于古代經典名方的中藥復方制劑,涵蓋:
-
按古代經典名方目錄管理的中藥復方制劑。
-
其他來源于古代經典名方的中藥復方制劑。包括未按古代經典名方目錄管理的古代經典名方中藥復方制劑和基于古代經典名方加減化裁的中藥復方制劑。
同名同方藥指通用名稱、處方、劑型、功能主治、用法及日用飲片量與已上市中藥相同,且在安全性、有效性、質量可控性方面不低于該已上市中藥的制劑。
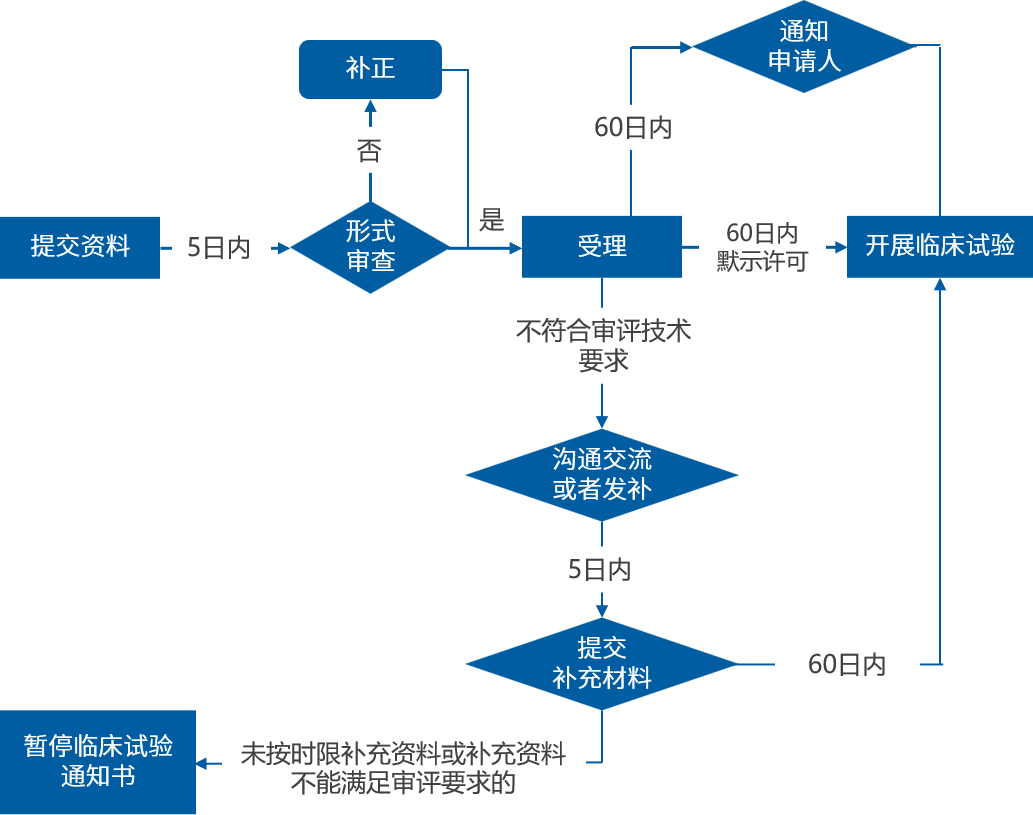
中藥臨床注冊申報流程
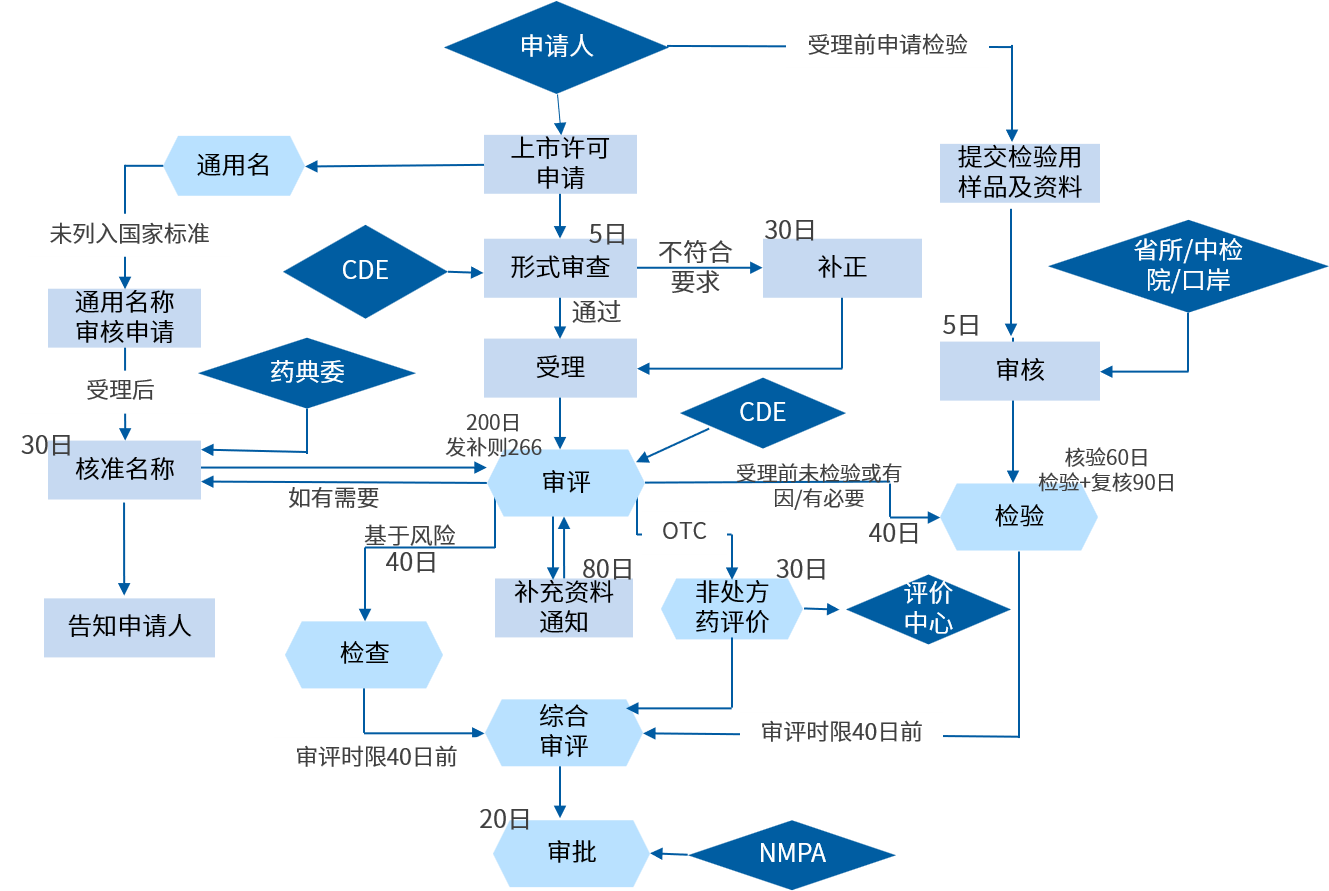
中藥報產注冊申報流程
古代經典名方中藥復方制劑簡化注冊審批

-END-



轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
