政策法規(guī)||中國新藥注冊臨床試驗(yàn)進(jìn)展年度報告(2021年)發(fā)布(附本周法規(guī)概覽06.06-06.10)
國家藥監(jiān)局藥審中心發(fā)布《中國新藥注冊臨床試驗(yàn)進(jìn)展年度報告(2021年)》
本次年度報告主要根據(jù)2021年度登記的藥物臨床試驗(yàn)信息,從藥物類型、品種及靶點(diǎn)特征、適應(yīng)癥、申辦者類型、注冊分類、試驗(yàn)分類、試驗(yàn)分期、特殊人群試驗(yàn)、臨床試驗(yàn)組長單位、啟動耗時和完成情況等角度對臨床試驗(yàn)的總體趨勢變化、主要特點(diǎn)、突出問題等進(jìn)行匯總分析,同時對比近三年臨床試驗(yàn)登記數(shù)據(jù),對近年來的趨勢特征進(jìn)行總結(jié)分析。

掃碼識別圖中二維碼
查看詳細(xì)信息

國家藥監(jiān)局藥審中心關(guān)于發(fā)布《罕見疾病藥物臨床研究統(tǒng)計學(xué)指導(dǎo)原則(試行)》的通告(2022年第33號)

掃碼識別圖中二維碼
查看詳細(xì)信息

NMPA
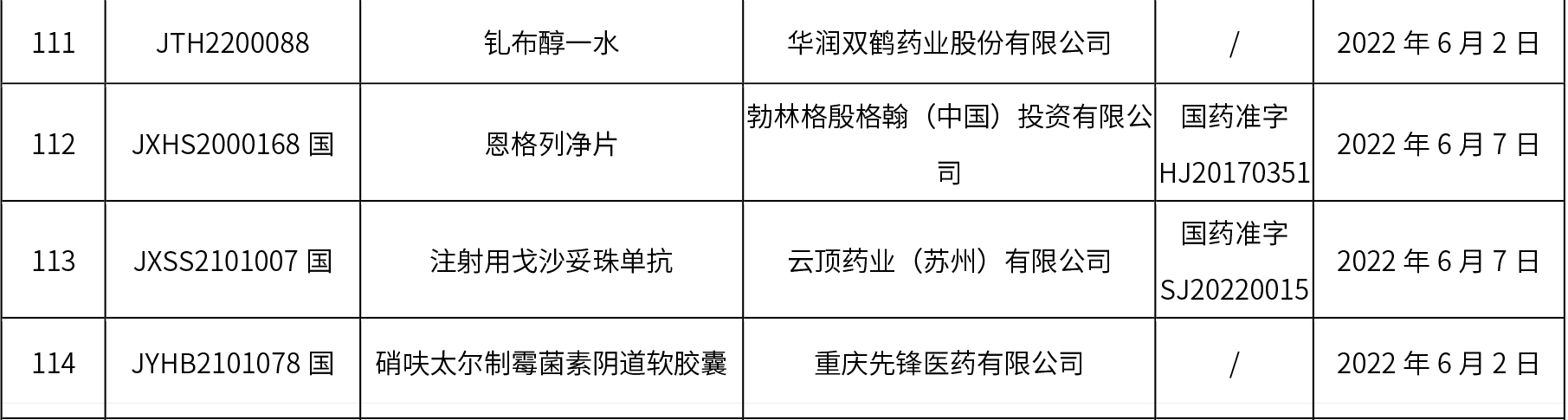
1、本周共發(fā)布了114個品規(guī)的藥品批準(zhǔn)證明文件待領(lǐng)取信息,其中一致性評價10個,注射劑48個。
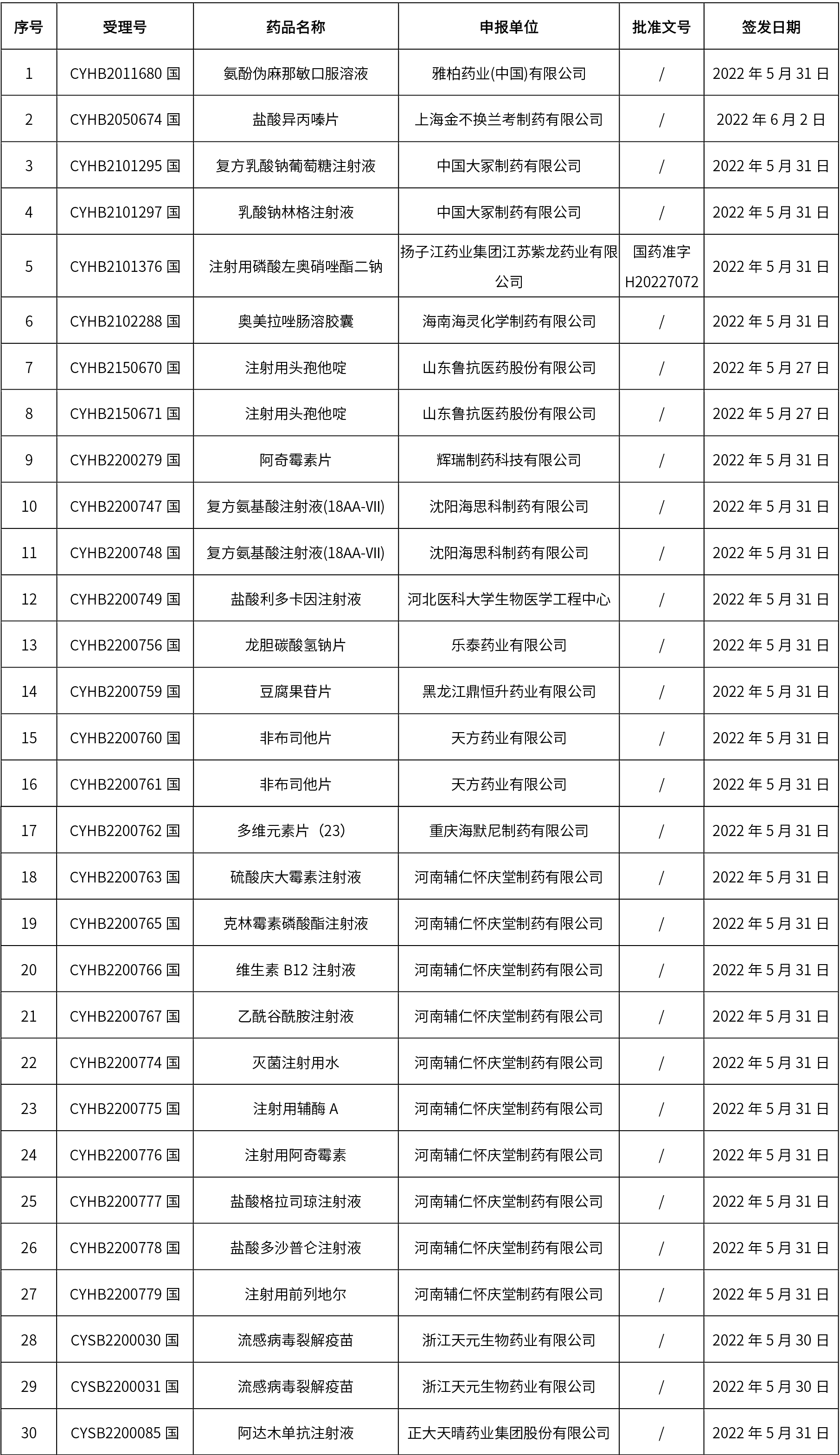
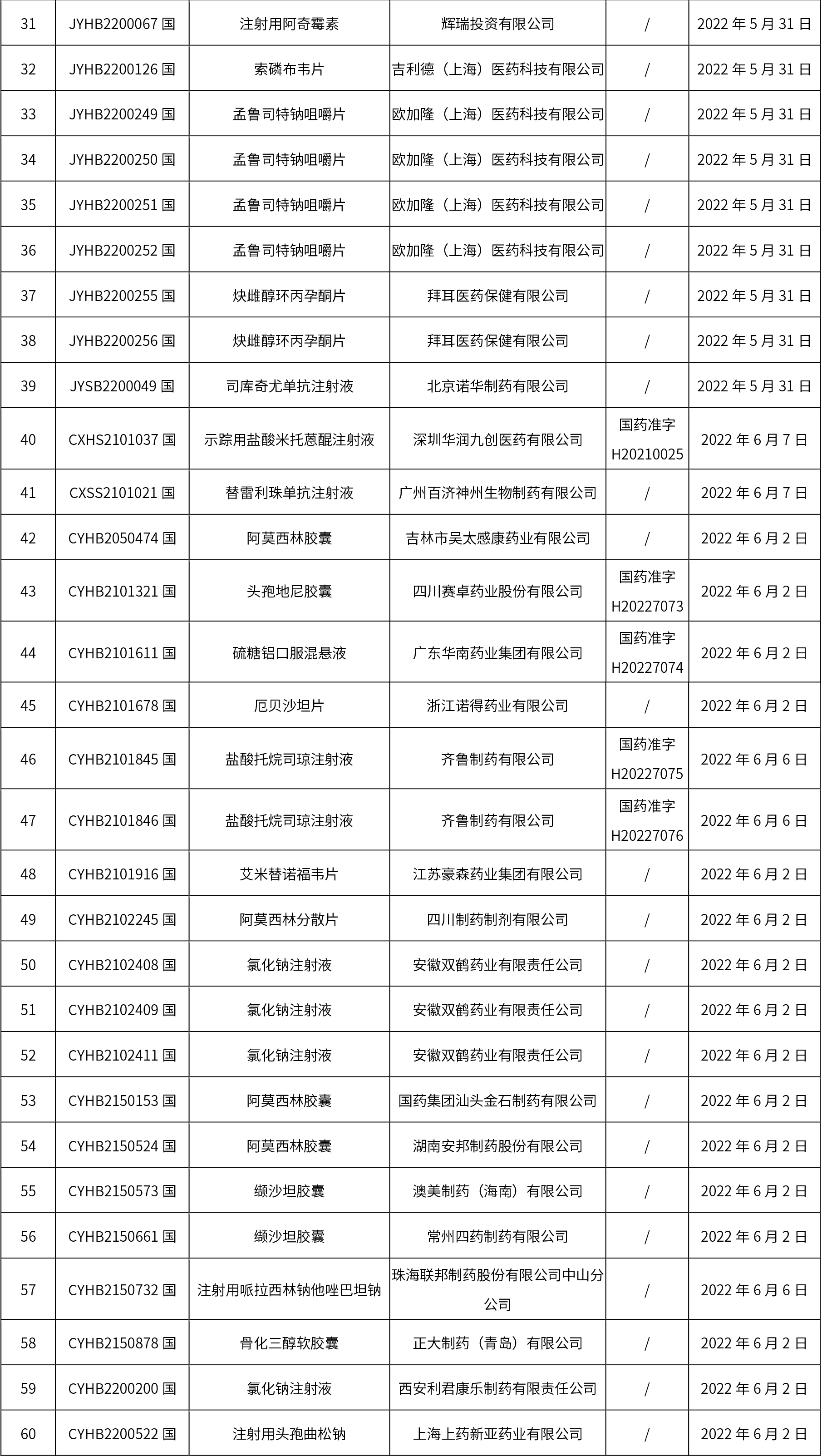
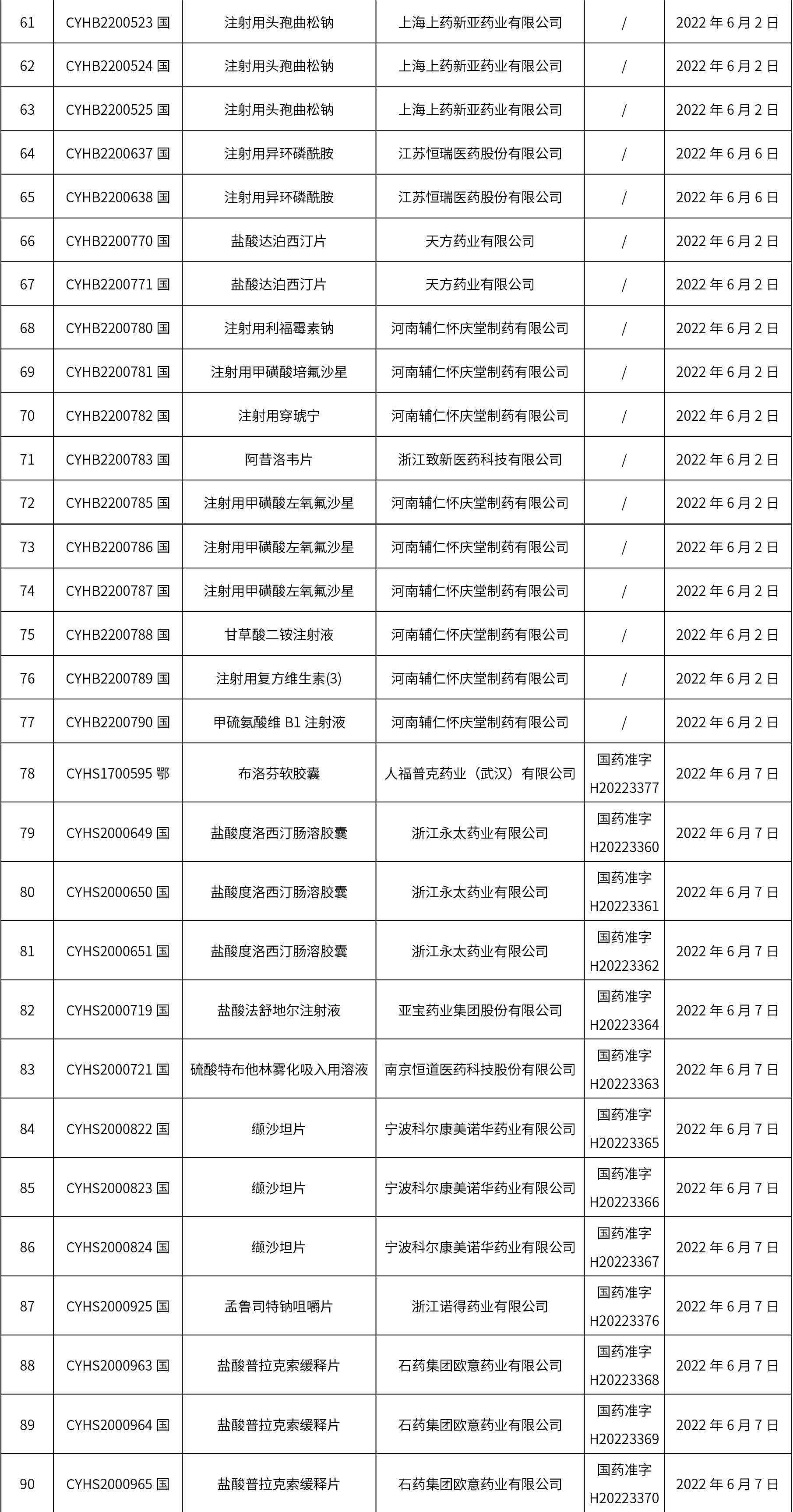
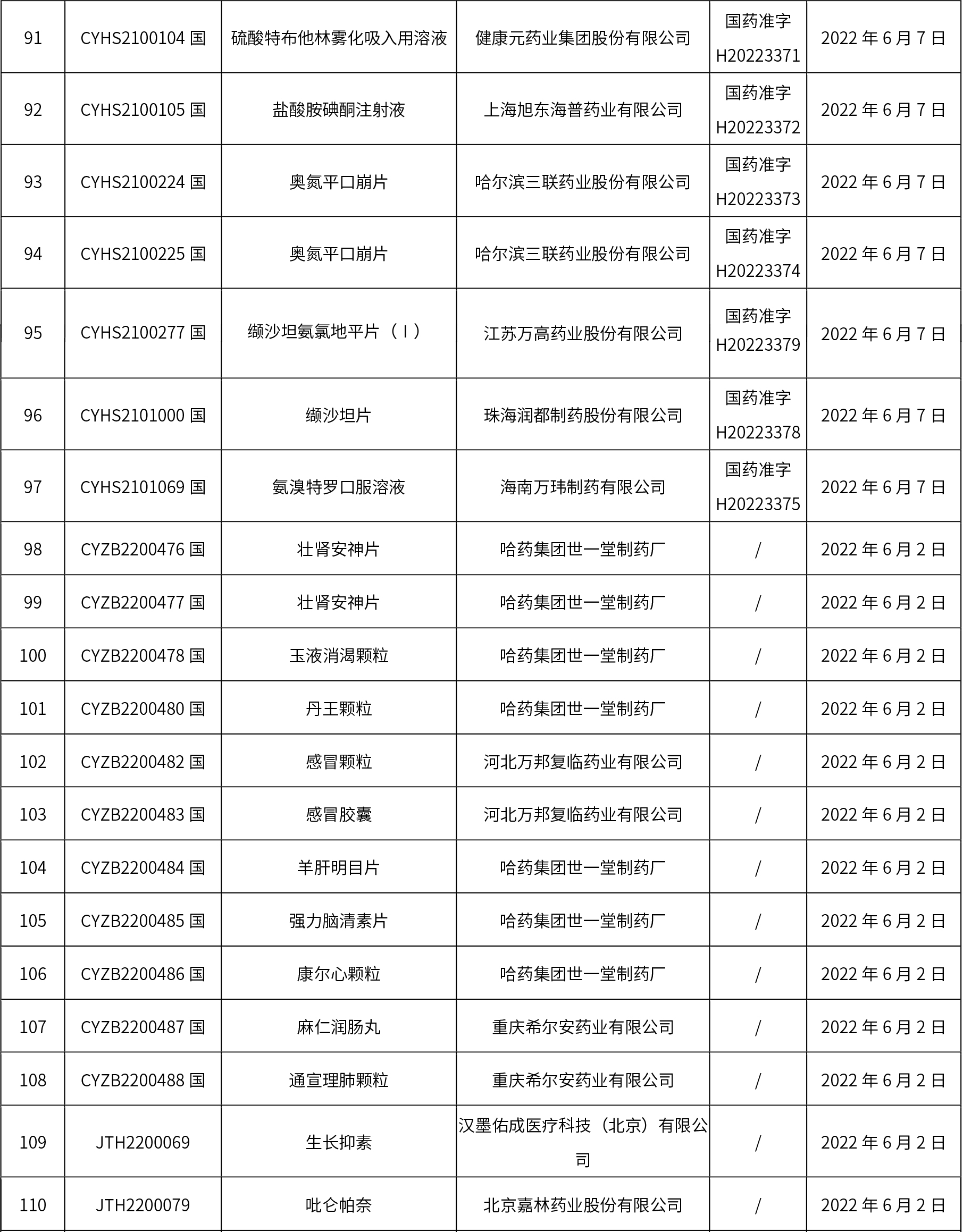
關(guān)于征求《中國藥典》藥包材生物學(xué)評價與試驗(yàn)選擇指導(dǎo)原則意見的通知
掃碼識別圖中二維碼
查看詳細(xì)信息

-END-



轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-61006450
Hotline服務(wù)熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場部:
技術(shù)市場部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
