解析 | 兒童用藥相關政策法規匯總分析
據2020年世界各國兒童(14歲及以下)人口總數統計,全世界兒童人口約為19.76億,我國兒童人口比例占世界約12.6%,兒童人口基數大,與之不匹配的兒童用藥稀缺,兒童用藥市場亟需拓展,為此國家出臺系列相關法規,便于企業及機構能夠加快兒童用藥研發進展,為廣大兒童的用藥健康提供保障。
背景概述
根據人用藥物注冊技術要求國際協調會(ICH)定義:
-
早產新生兒
-
足月新生兒——0-27天
-
嬰幼兒——28天-23個月
-
兒童——24個月-11周歲
-
青少年——12-17周歲
市場現狀
-
3500多種藥品中,供兒童專用的不足60種,1.7%;
-
18萬條藥品注冊批件中,兒童專用藥3000多條,涉及400個品種,占比不足2%;且主要以顆粒劑為主;
-
全國6000多家藥品生產企業,其中涉及兒童藥生產企業1000多家,專門生產兒童用藥企業不足10家,占比不足1%。
-
抗菌藥物不合理使用
-
靜脈注射過渡使用
-
中藥安全性問題
-
超說明書用藥
《關于改革藥品醫療器械審評審批制度的意見》國發〔2015〕44號
加快轉移到境內生產的創新藥和兒童藥的審評審批。
《臨床急需兒童用藥申請優先審評審批的品種評定的基本原則 》
新增用于兒童人群品種:
-
針對嚴重威脅兒童生命或者影響兒童生長發育,且目前無有效治療藥物或治療手段的疾病;
-
相比現有的治療藥物,具有明顯治療優勢。
改劑型或新增規格品種:
-
國內現行藥品說明書中包含有確定的“兒童用法用量”;
-
現有劑型或規格均不適用于兒童,新增劑型或規格適合于兒童。
仿制品種:
-
對于目前市場短缺的兒童用藥品。
2017.12.27
《關于鼓勵藥品創新試行優先審評審批的意見》 食藥監藥化管(2017)126號
防治下列疾病且具有明顯臨床優勢的藥品注冊申請:艾滋病;肺結核;病毒性肝炎;罕見病;惡性腫瘤;兒童用藥品;老年人特有和多發的疾病。
《中華人民共和國藥品管理法》
鼓勵兒童藥品研制和創新,支持開發符合兒童生理特征的兒童用藥新品種、劑型和規格。
《藥品注冊管理辦法》
第六十八條 藥品上市許可申請時,以下具有明顯臨床價值的藥品,可以申請適用優先審評審批程序:(二)符合兒童生理特征的兒童用藥品新品種、劑型和規格。
《藥品上市許可優先審評審批工作程序(試行) 》
適用范圍:
-
臨床急需的短缺藥品、防治重大傳染病和罕見病等疾病的創新藥和改良型新藥;
-
符合兒童生理特征的兒童用藥品新品種、劑型和規格;
-
疾病預防、控制急需的疫苗和創新疫苗;
-
納入突破性治療藥物程序的藥品;
-
符合附條件批準的藥品;
-
國家藥品監督管理局規定其他優先審評審批的情形。
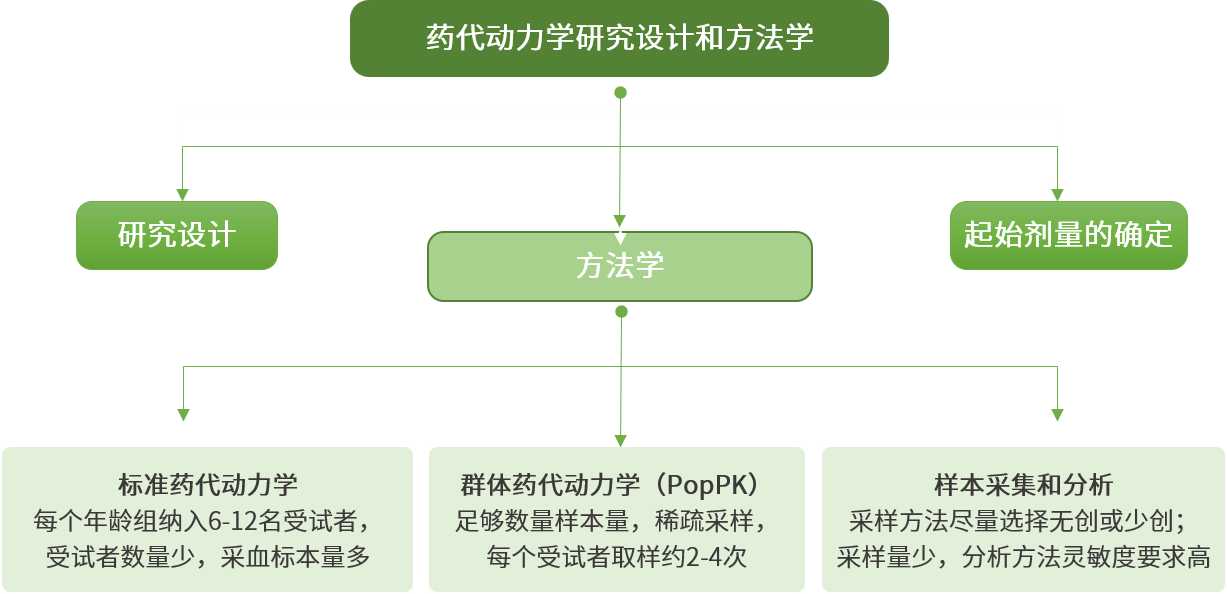
知情同意:
-
低年齡段的兒科人群,須征得其法定監護人的知情同意并簽署知情同意書。
-
當兒童有知情同意的能力可以作出參加研究的決定時,還必須同時征得其本人同意。
風險最小化原則:
-
要求研究人員接受良好培訓且有豐富的兒科研究經驗,包括具備評估和處理潛在的兒科人群不良事件的能力。
-
應事先建立應急機制確保在發現未預期的風險時能夠迅速中止研究和實施補救措施。
痛苦最小化原則:
-
研究實施中應充分考慮到兒科受試者的心理感受,加強安撫,營造合適的環境,最大程度減少兒科受試者的痛苦。
2、《兒科人群藥物臨床試驗技術指導原則》
倫理委員會:兒科藥學;兒科臨床醫學;兒童心理學;律師;社區代表(老師、育有子女父母)。
試驗機構:CFDA認證的兒科人群藥物臨床試驗機構。
情形一:擬用于兒科特有疾病或患者主要為兒科人群的疾病的藥物。
-
如果成人無法提供充分信息,則在獲得了成人的初步安全性和藥代動力學數據之后,即可在目標年齡段兒科人群中開展臨床試驗。
情形二:擬用于成人和兒科人群共患疾病的藥物。
-
如果該疾病是目前缺乏有效治療的危重癥或進展性預后不良疾病,應考慮在獲得成人初步安全性及潛在獲益的臨床試驗數據后,例如II期結束或完成概念驗證性研究后,盡早地開展兒科人群臨床試驗;
-
如果該疾病已有可選擇的治療藥物,應在成人III期確證性研究證明了其在成人患者中的獲益大于風險后,再啟動兒科人群臨床試驗;
-
如果預期有較大的安全性風險,建議在該藥品成人應用上市后獲得充分的安全性數據時再開展兒科人群藥物臨床試驗。
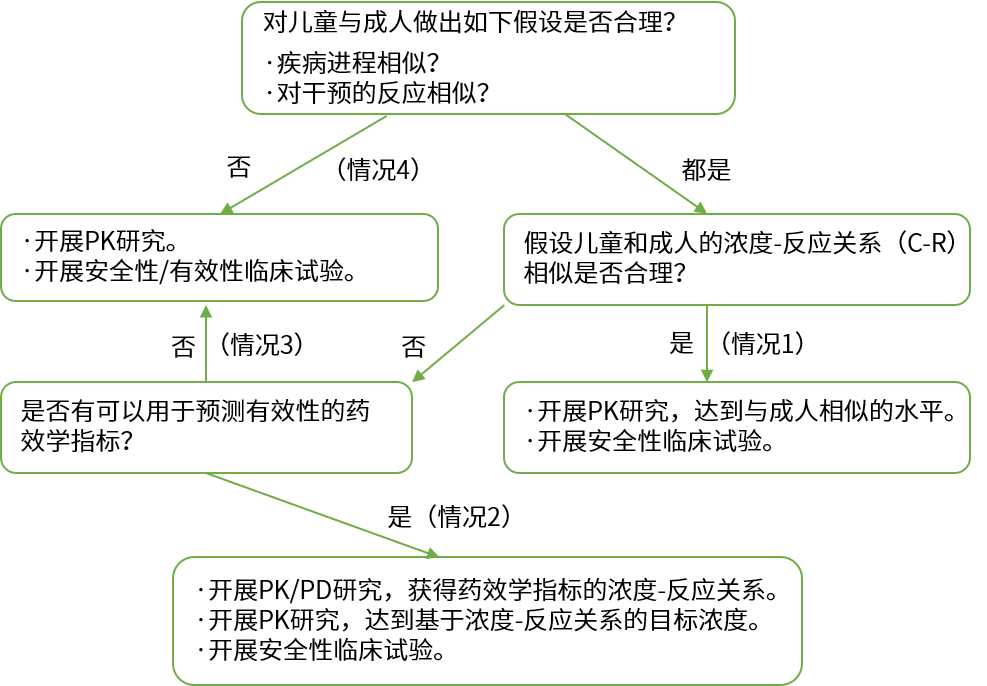
原則:成人臨床試驗數據向兒科人群的外推限于療效數據;兒科人群安全性數據需要在兒科人群中開展試驗。
決策:目標適應癥的疾病進程和治療反應在成人和兒科人群間是否相似;.藥物的體內暴露效應關系(Exposure-Response relationship)在成人和兒科人群間是否相似。
相似:PK確認或通過外推獲得劑量,在特定的兒科人群開展隨機對照試驗,重點是獲得該人群的安全性數據,同時,可以驗證擬定劑量的合理性。
不相似:不具備外推成人療效數據的條件,需開展全面系統的兒科人群藥物臨床試驗。
評價指標的選擇:需要良好配合和充分理解的指標,例如,疼痛評估、肺功能檢查。
安慰劑對照的設立:
-
當沒有其他可接受的治療方法,受試藥物是首個可能有效的藥物時;
-
當常規使用的治療方法的有效性未得到確證時;
-
當常規使用的治療方法伴隨嚴重的、高發的不良反應,且風險可能明顯大于獲益時;
-
當用于證明一種已被確證療效的治療附加另一種新的治療后的有效性時;
-
疾病的進程具有不確定性時,例如自發惡化或緩解;
-
需要確定藥物的絕對有效性時。
生長發育的監測:兒科人群藥物臨床試驗的隨訪時間通常較成人試驗長,用以觀察對生長發育的影響。
主旨:數據外推主要針對有效性數據,以獲得明確的劑量。
適用范圍:已有中國成人數據的產品外推至中國兒科人群,無中國成人數據產品的外推不在本指導原則中體現。
概念:通過科學的研究方法,將已知中國成人的研究信息和結論,擴展到未知的兒科人群(目標人群)從而減少在未知兒科人群開展不必要的研究。
建立外推假設:整合已知數據,評價已知人群與目標人群的相似性和差異點,借助建模模擬的方法,明確提出外推假設,獲得預測指標。
設計外推計劃:基于外推假設,制定目標人群研究計劃,包括哪些數據可直接通過外推獲得,哪些需設計簡化的臨床試驗或完整系統的臨床試驗獲得。
實施外推分析:解釋在目標人群中獲得的有限數據,驗證外推假設,確證/驗證已知人群和目標人群相似性。
附:美國食品藥品管理局(FDA)的兒科人群研究設計與外推決策流程圖
4、《兒童用藥(化學藥品)藥學開發指導原則(試行)》
信息收集與分析:首先收集關于該藥物的已有研究信息,例如成人的藥代動力學和部分藥效學數據、非臨床研究數據、原料藥的關鍵理化特性、原料藥和成人用制劑的質量屬性和穩定性等。
初步選擇合適的給藥途徑和劑型:鼓勵申請人基于兒童人群特點和臨床需求,開發適宜兒童使用的新劑型。
擬定劑型,確定目標產品質量情況:應對藥物安全性、有效性和患者可接受性等方面進行重點評。
產品開發實施:建議特別關注兒童患者的可接受性,包括包裝系統、給藥裝置和量取裝置的適用性和合理性等。
附藥物臨床試驗相關英文縮寫名詞解釋:
BA:Bioavailability,生物利用度
BE:Bioequivalence,生物等效性
BSA:Body surface area,體表面積
E-R:Exposure-Response,暴露-效應
PBPK:Physiologically based pharmacokinetic,基于生理的藥動學模型
PD:Pharmacodynamics,藥效動力學
PK:Pharmacokinetics,藥代動力學
popPK:Population Pharmacokinetics,群體藥代動力學
-END-



轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
