思路剖析 | 腸溶制劑的開發思路及難點
隨著一致性評價的展開,國內仿制藥競爭愈加激烈;4+7 帶量采購政策的出臺,代表著中國仿制藥市場進入低利潤時代。在此研發背景下,仿制技術壁壘較高的高端制劑有望協助企業提升產品品質,拓寬產品線,提高綜合競爭力。本文就腸溶制劑開發思路與難點與大家進行分享。
腸溶制劑一般是在口服藥物外部包一層薄膜衣,而藥物是否包腸溶衣是由藥物性質和藥物使用的目的決定的。
包腸溶衣的藥物一般分為以下幾類:
-
遇酸不穩定的藥物,如:質子泵抑制劑,蘭索拉唑、奧美拉唑、泮托拉唑(第一代);雷貝拉唑、艾司奧美拉唑(第二代)等;
-
對胃刺激性強的藥物,如:雙氯芬酸鈉腸溶片、鹽酸二甲雙胍腸溶片等;
-
作用于腸道的驅蟲藥、腸道消毒藥或需要其在腸道保持較久的時間以延長藥物作用促進生物利用度等如泊沙康唑腸溶片。
腸溶制劑憑借其獨特的臨床優勢,誕生了數個重磅產品,如質子泵抑制劑類,心血管疾病一線治療藥物阿司匹林腸溶片,新型抗真菌藥物泊沙康唑腸溶片和腸溶干混懸劑以及抑郁市場主力產品度洛西汀腸溶膠囊等。
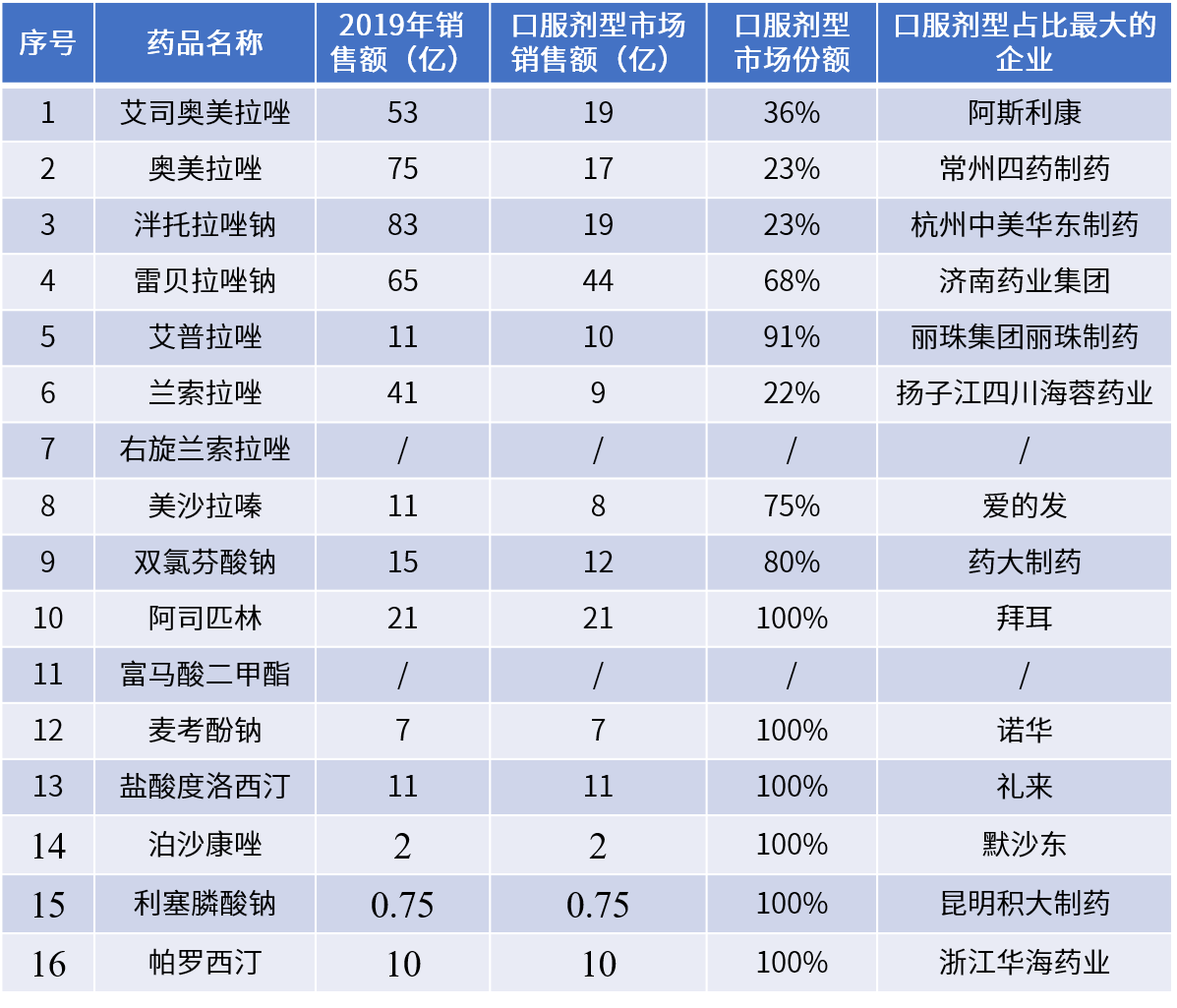
(數據來源:藥酚享)
代表藥物:泮托拉唑腸溶片、阿司匹林腸溶片、雷貝拉唑鈉腸溶片、雙氯芬酸鈉腸溶片等
采用一般制粒工藝如:濕法制粒、流化床制粒、干法制粒后獲得顆粒,或直接采用粉末直壓工藝,采用常規壓片機進行壓片獲得素片,在普通包衣鍋中,采用片劑包衣技術進行包衣,通常在包腸溶衣前需包一層隔離層,以增加藥物穩定性。
代表藥物:奧美拉唑腸溶膠囊
腸溶膠囊,一般均為微丸灌裝膠囊,通常采用濕法制軟材(較濕法制粒軟材黏),采用擠出滾圓設備進行滾圓,采用流化床進行干燥,干燥至一定程度后采用流化床底噴進行包衣,常在包腸溶衣之前需包一層隔離層,增加藥物穩定性。擠出滾圓時擠出原理(籃式擠出或螺桿擠出)、微丸粒徑及圓整度均影響包衣效果,需重點控制。
代表藥物:艾司奧美拉唑腸溶片、蘭索拉唑腸溶膠囊
采用空白丸芯如蔗糖丸芯,采用原料藥溶液進行流化床底噴上藥,后再顆粒包一臺流化床即可完成微丸上藥、包衣,但微丸上藥率,包衣均勻度難度較高。
代表藥物:泊沙康唑腸溶片、泊沙康唑腸溶干混懸劑
采用熱熔擠出設備進行擠出,獲得帶藥物料,采用粉碎整粒設備進行整粒, 獲得合適粒徑顆粒之后再進行壓片,包腸溶衣。
復雜制劑由內而外進行研究,依次為參比制劑剖析、處方前研究-原輔料、片芯/丸芯處方篩選、隔離層包衣研究和腸溶包衣研究。
關鍵開發點:
-
腸溶包衣材料確認
-
電鏡顯微觀察,確認參比結構及原研工藝,初步確認包衣增重
-
多批次參比制劑溶出曲線剖析
具體內容:
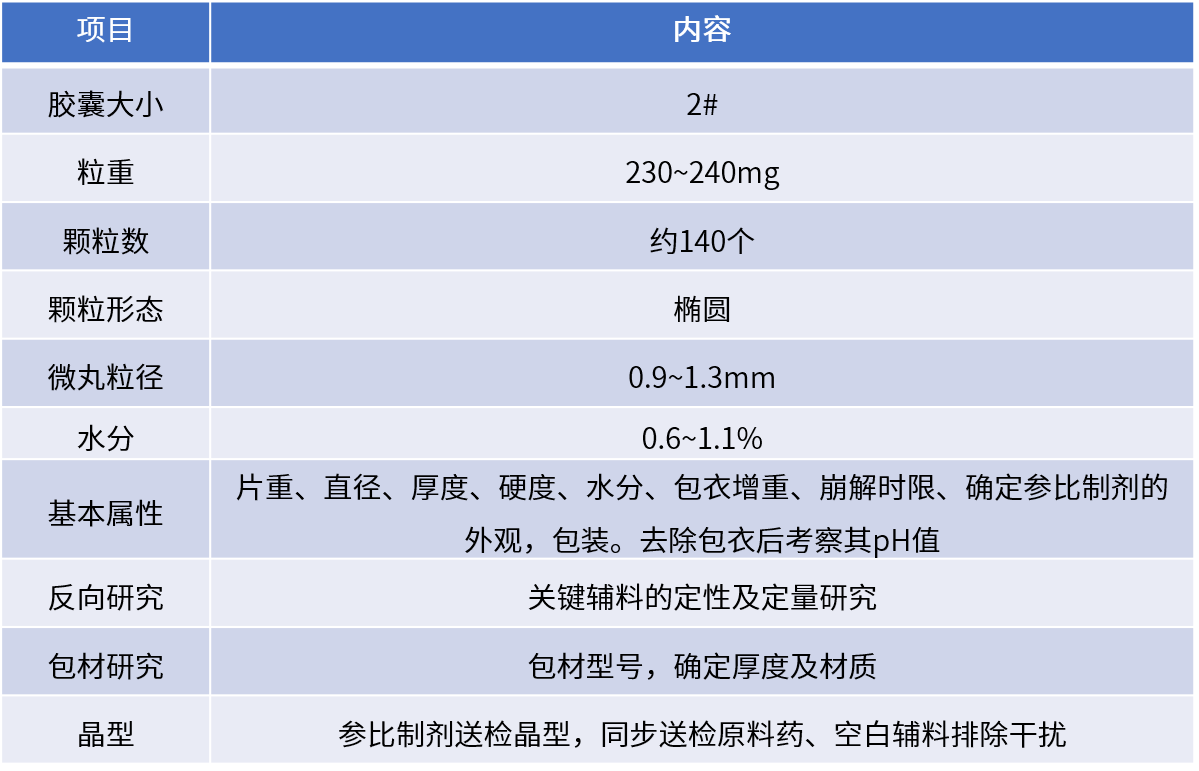
關鍵開發點:
-
原料藥粉體學確認,粒徑、溶解性確認
-
輔料組成及輔料特性確認
-
原輔料相容性確認穩定性趨勢
具體內容:
-
工藝的可行性,產品的穩定性及BE
-
產品的溶出行為
關鍵質量屬性:
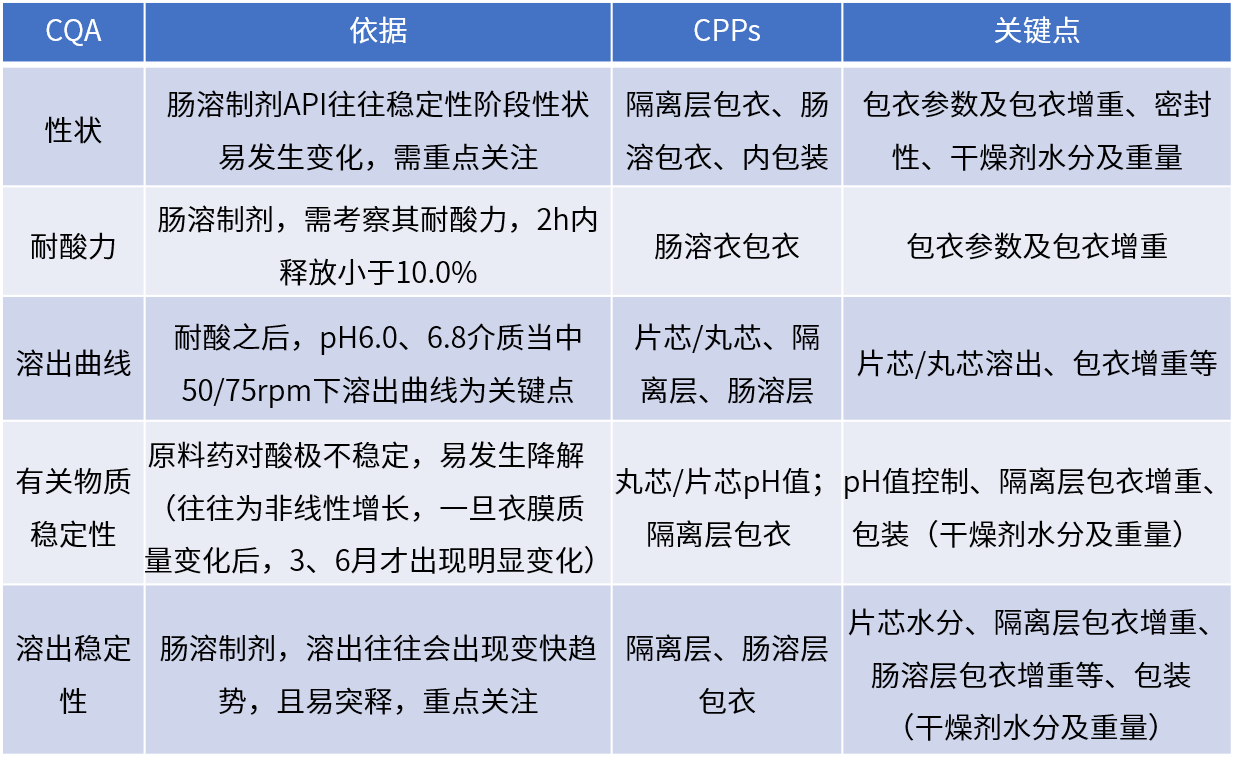
具體內容:
-
采用多批次原研參比制劑去除隔離層、腸溶層后僅剩余片芯,考察片芯性質
-
明確丸芯研發目標(大小、粒徑、圓整度、溶出)
具體內容:
-
以溶出及穩定性為考察指標,考察不同隔離層包衣增重對穩定性的影響,確定包衣增重
具體內容:
-
重點以耐酸力為考察指標,考察腸溶層包衣粉來源、包衣增重的影響
-
耐酸力符合要求之后再次以溶出及穩定性為考察指標對腸溶層進行研究
-
如何選擇參比制劑?選擇幾批?如何選擇具有多個產地參比生產商?
-
溶出剖析時,每次檢測差異較大(pH4.5+6.0),如何考慮?(不同緩沖鹽、不同離子濃度、不同配樣投樣方式、不同方法)
-
小試處方工藝重現性不好,如何考慮?(批量放大、不同包衣參數再次考察或者控制環境及進風含水量?)直接上中試設備放大驗證?
-
預BE結果不理想,但各介質溶出均能擬合,如何考慮?
-
無體內外相關性,完全舍棄原有曲線評估?增加苛刻條件,再次提高各介質相似因子?
以上為腸溶制劑品種開發的重點關注點,開展研究前,需充分針對相關問題進行調研分析討論,制定合理的開發方案,為后期品種的進一步研究奠定基礎。
-END-



轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
