年終盤點 | 2021年度藥政法規十大關鍵詞
凡是過往,皆為序章
2021年,藥品管理法配套措施逐步落地
對于醫藥人而言
有很多值得被銘記的時刻
也有很多被值得記憶的“關鍵詞”。

藥物警戒是與發現、評價、理解和預防不良反應或其他任何可能與藥物有關問題的科學研究與活動,在發現和預防藥品安全風險等方面的作用至關重要。
- 2021年11月8日,國家藥品不良反應監測中心發布《藥物警戒體系主文件撰寫指南》(征求意見稿)
- 2021年12月1日,國家局綜合司發布《藥物警戒檢查指導原則》(征求意見稿)。《藥物警戒質量管理規范》正式實施,意味著藥物警戒制度在中國邁出了堅實的一步。
藥物警戒系列文件的相繼出臺為藥物警戒制度的加快落地奠定了堅實的基礎。期待建立更加健全完善的藥物警戒制度體系,為公眾健康保駕護航。

NMPA于2017加入ICH,并在CDE設立ICH辦公室。ICH指導原則共 63個,明確實施時間點59個,已轉化實施53個。ICH指導原則的轉化實施為e-CTD的實施奠定了基礎。
- 2021年9月29日,NMPA發布《國家藥監局關于實施藥品電子通用技術文檔申報的公告》(2021年第119號),明確自2021年12月29日起,化學藥品注冊分類1類、5.1類,以及治療用生物制品1類和預防用生物制品1類的上市許可申請,可按照eCTD進行申報。這表明中國正式進入eCTD申報時代。
- 2021年11月18日,CDE聯合中國藥品監督管理研究會舉辦了eCTD 申報培訓,并在線上培訓后一個月公布了培訓資料,供企業查看學習。
- 2021年12月10日,CDE官網公布了eCTD 驗證軟件和PDF文件批量電子簽章軟件,可免費下載使用。
這一系列舉措均表明eCTD的全面實施勢在必行,申請人可根據實際情況采購eCTD申報軟件或與第三方合作,以便盡快適應eCTD申報模式。
- 2021年7月,國家藥品監督管理局聯合國家知識產權局發布《藥品專 利糾紛早期解決機制實施辦法(試行)》及《藥品專利糾紛早期解決機制實施辦法(試行)》政策解讀。
《藥品專利糾紛早期解決機制實施辦法(試行)》也被稱為是中國特色的藥品專利鏈接制度,在中國首次將藥品審評審批與藥品專利相鏈接,在藥品監管實踐層面具有一定的創新性。
藥品專利鏈接制度一方面充分考慮藥物專利,鼓勵藥物創新,另一方面設立專利挑戰,給予專利挑戰成功的首仿藥12個月的市場獨占期,一定程度上可平衡創新藥和仿制藥的發展。
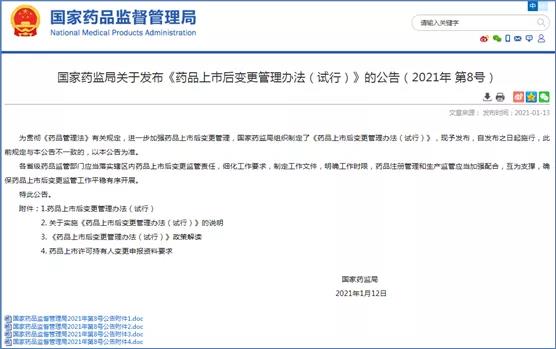
2021年,NMPA 及CDE陸續發布變更指導原則,涉及化藥、中藥及生物藥藥學/臨床變更研究、變更程序、變更受理審查指南。明確了變更研究內容,疏通了變更申報路徑。
2021年開年發布的《藥品上市后變更管理辦法》(試行)明確了MAH路徑及變更資料要求,同時明確了MAH變更同時伴隨生產場地變更、工藝變更及質量標準變更的注冊申報路徑。對于變更風險等級的劃分,可通過與省局/CDE溝通確認,優化了監管服務,進一步體現了“放管服”的要求。
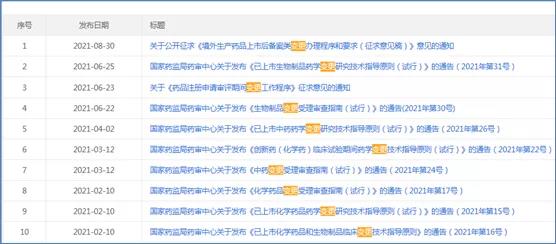
參比制劑目錄作為仿制藥立項的風向標,注冊申報受理的頭號關卡,備受矚目。
2021年共發布了《化學仿制藥參比制劑目錄》19批,截止2021年12月31日已發布五十三批(第50-53批為征求意見稿)。同時也公布了一些未通過審議參比制劑的原因,包括安全性和有效性、不具有參比制劑地位以及無菌生產工藝/滅菌工藝選擇問題等。
隨著一致性評價制度的推進,CDE亦發布《臨床價值明確,無法推薦參比制劑的化學藥品目錄》,但未發布正式稿。醫藥企業翹首以盼,期待盡快落地!
- 2017年國務院發布發布的42號文,明確提出“支持罕見病治療藥品醫療器械研發。罕見病治療藥品醫療器械注冊申請人可提出減免臨床試驗的申請。”
- 2021年9月11日,《中國罕見病定義研究報告2021》在上海發布,報告中首次提出了“中國罕見病2021年版定義”,即應將“新生兒發病率小于1/萬、患病率小于1/萬、患病人數小于14萬的疾病”列入罕見病。
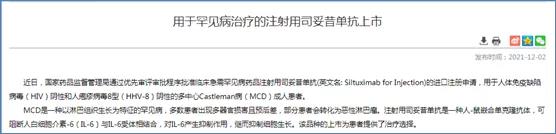
2021年,CDE發布兩則關于罕見病用藥的臨床研發指導原則,通過優先審評審批方式批準2款罕見病用藥,分別為奧法妥木單抗注射液(用于治療成人復發型多發性硬化(RMS)) 和注射用司妥昔單抗(用于人體免疫缺陷病毒(HIV)陰性和人皰疹病毒8型(HHV-8)陰性的多中心Castleman病(MCD)成人患者)。
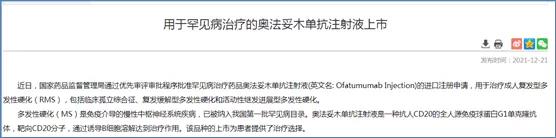
在仿制藥市場紅利逐漸減弱的情況下,企業不妨抓住政策機遇,另辟蹊徑,采用license in或與深耕罕見病研發的國內外研究機構合作,布局罕見病領域,提前搶占罕見病用藥市場。
國家從多維度推動兒童用藥的可及性,如政策法規層面鼓勵研發創新, 審評審批方面將兒童用藥新藥納入優先審評審批范疇,開通“兒童用藥專欄”,并將與兒童用藥相關的政策法規、指導原則及培訓資料等予以集中公開,打出了鼓勵創新、提升效率,強化服務的“組合拳”。
截止目前,CDE共發布10余個關于兒童用藥的指導原則,涉及臨床研究及藥學研究,并明確了成人用藥數據外推至兒科人群的技術要求,其中2021年CDE共發布2項關于兒童用藥指導原則。隨著國家監管政策的傾斜,兒童用藥也逐步成為制藥企業重要的戰略布局點。

- 2017年10月8日,國務院發布《關于深化審評審批制度改革鼓勵藥品 醫療器械創新的意見》(廳字〔2017〕42號)。作為綱領性文件,42號文指明了藥品審評審批制度改革的方向。
- 2021年,CDE共發布4個關于創新藥的指導原則,持續釋放政策利好信息;NMPA通過優先審評審批通道共批準包括帕米帕利膠囊在內19款創新藥,均為具有我國自主知識產權的新藥,有效促進了未滿足的臨床需求!
2015年1月,前美國總統奧巴馬在國情咨文中提出“精準醫學”行動策略,隨之眾多企業將細胞治療和基因治療療法納入其戰略布局。同時,隨著CAR-T療法的火熱,細胞治療進入了大眾視野。
- 2021年,CDE發布10項細胞/基因治療產品研究指導原則,涉及非臨床研究、藥學研究、臨床研究;NMPA批準國內首款CAR-T細胞療法-阿基倫賽注射液(用于治療既往接受二線或以上系統性治療后復發或難治性大B細胞淋巴瘤成人患者)上市,這也是我國首個批準上市的細胞治療類產品。

2021年,CDE共發布臨床/非臨床試驗指導原則數量:34個,包括創新藥、抗腫瘤藥、基因治療產品、抗新冠病毒藥物、兒童用藥以及個藥指南等。
從發布的指導原則中可得出兩個鮮明的“特征”:
-
“私人訂制”,發布多個個藥指南以及某治療領域產品臨床研究指導原則,這對于申辦方規范臨床研究明確研究方向具有重要意義;
-
從“跟隨”到“領跑”,如首創新的發布抗新冠病毒化學藥品非臨床研究指導原則。中國監管當局在不斷優化監管環境,強化服務。
2022年,藥政法規將進一步完善和全面,
希望醫藥企業能夠按照法規要求及時調整修改,
為醫藥的研發保駕護航,
助力醫藥大健康!
-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
