專題分享 | 藥品生產(chǎn)設(shè)備清潔殘留限度確認及分析方法驗證
藥品生產(chǎn)后必須對其生產(chǎn)設(shè)備采取一定的程序進行清洗,防止藥物成分殘留到下一批產(chǎn)品中,形成交叉污染,從而影響下一批產(chǎn)品的質(zhì)量及安全性。清潔驗證是證實清洗程序合理性的必要技術(shù)手段。
WHO、EU、ICH、FDA及我國藥品GMP均對藥品生產(chǎn)清潔驗證提出了相關(guān)要求:
1)使用同一生產(chǎn)設(shè)備生產(chǎn)不同的產(chǎn)品,必須進行清潔驗證,確定可接受藥物殘留水平。
2)當同一設(shè)備僅生產(chǎn)一種產(chǎn)品時,不涉及交叉污染,無需開展系統(tǒng)的殘留物限度清潔驗證,通常通過目視法檢查設(shè)備表面無可見殘留物并保障微生物水平即可。
清潔驗證的取樣方法主要有擦拭取樣法(直接取樣)和淋洗取樣法(間接取樣),為達到清潔目的,兩種方法可結(jié)合使用。通常根據(jù)待清潔品種各組成成分的清潔難易程度、溶解度和允許最大殘留量(MACO值)來確定需要清潔的組分。
本文參照歐洲原料藥委員會(APIC)在原料藥工廠清潔驗證指南(2016.09)中給出的藥物活性成分殘留限度的確定方法,結(jié)合國內(nèi)清潔驗證限度確定相關(guān)文獻,對藥品生產(chǎn)設(shè)備清潔中活性成分殘留限度確認方法進行簡要歸納,并初步擬定待清潔活性成分的分析檢測方法驗證方案。
(清潔驗證的接受標準)
在可以獲得可接受日暴露水平(ADE) 或允許日暴露量(PDE) 值時 ,可采用ADE或PDE值計算最大允許殘留量(MACO)。
首先,計算ADE值或PDE值,計算公式如下:
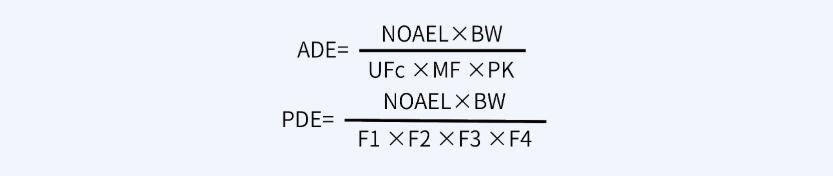
其次,根據(jù)ADE值或PDE值計算MACO值,計算公式如下:

當多品種共線生產(chǎn)時,可以選擇ADE或PDE值較小的品種作為上一產(chǎn)品,選擇MBS/TDD比值最小的品種作為生產(chǎn)的下一產(chǎn)品。
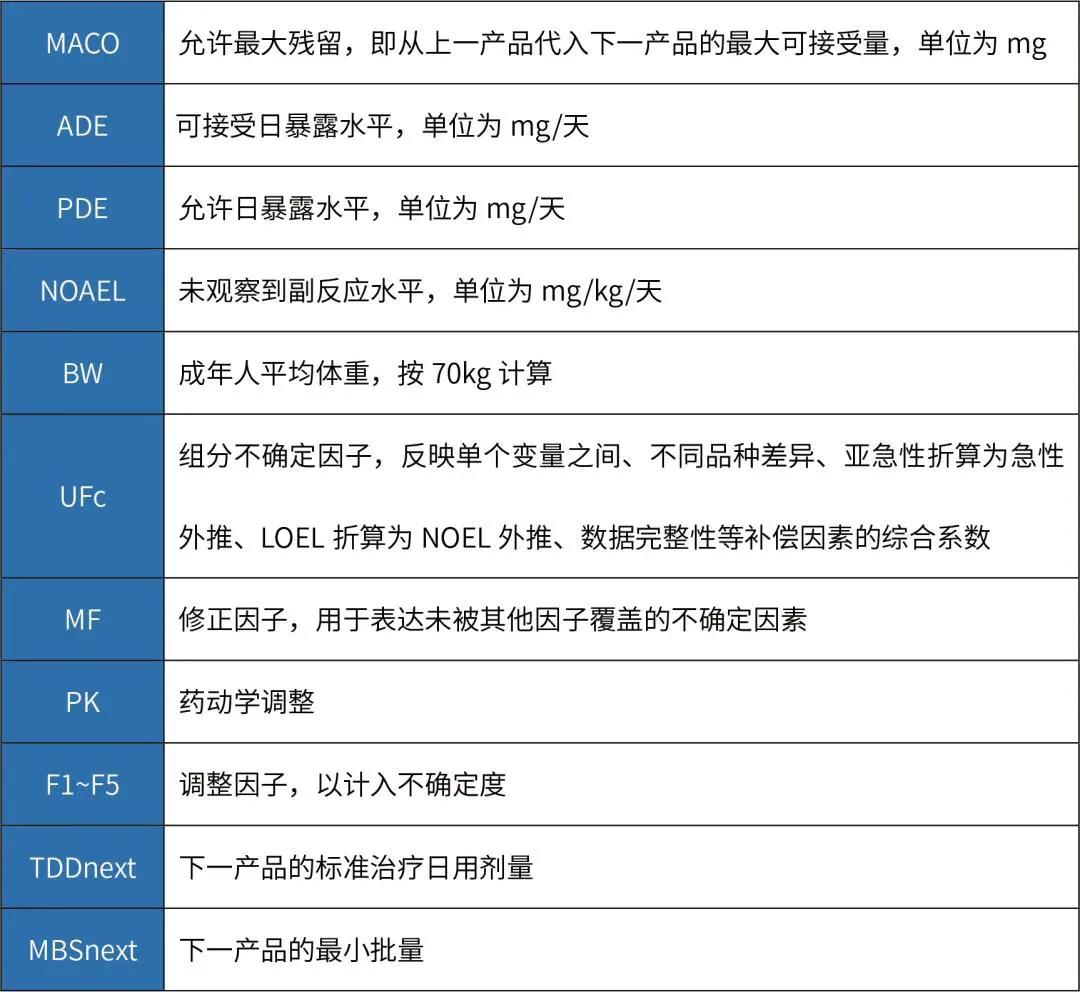
如果可以獲得有限毒性數(shù)據(jù)和日治療劑量(TDD)值,可以采用本計算方式,就原料藥而言,該公式適用于原料藥生產(chǎn)工藝A更換到原料藥生產(chǎn)工藝B的情況。計算公式如下:
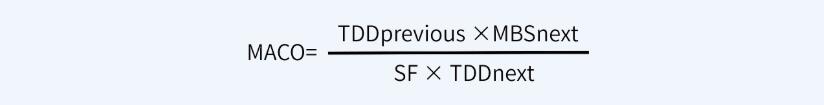

如果無法獲得其它數(shù)據(jù)(例如, ADE、 OEL、 TDD等值),僅能獲得半數(shù)致死量數(shù)據(jù)(例如化學(xué)物質(zhì)、中間體、清潔劑等), MACO可以基于半數(shù)致死量數(shù)據(jù)來計算 。
首先,計算NOEL值(無可見影響水平):
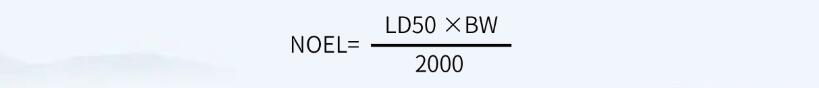
其次,根據(jù)NOEL值計算MACO值:
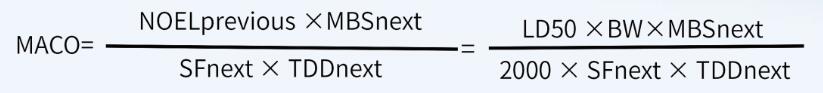
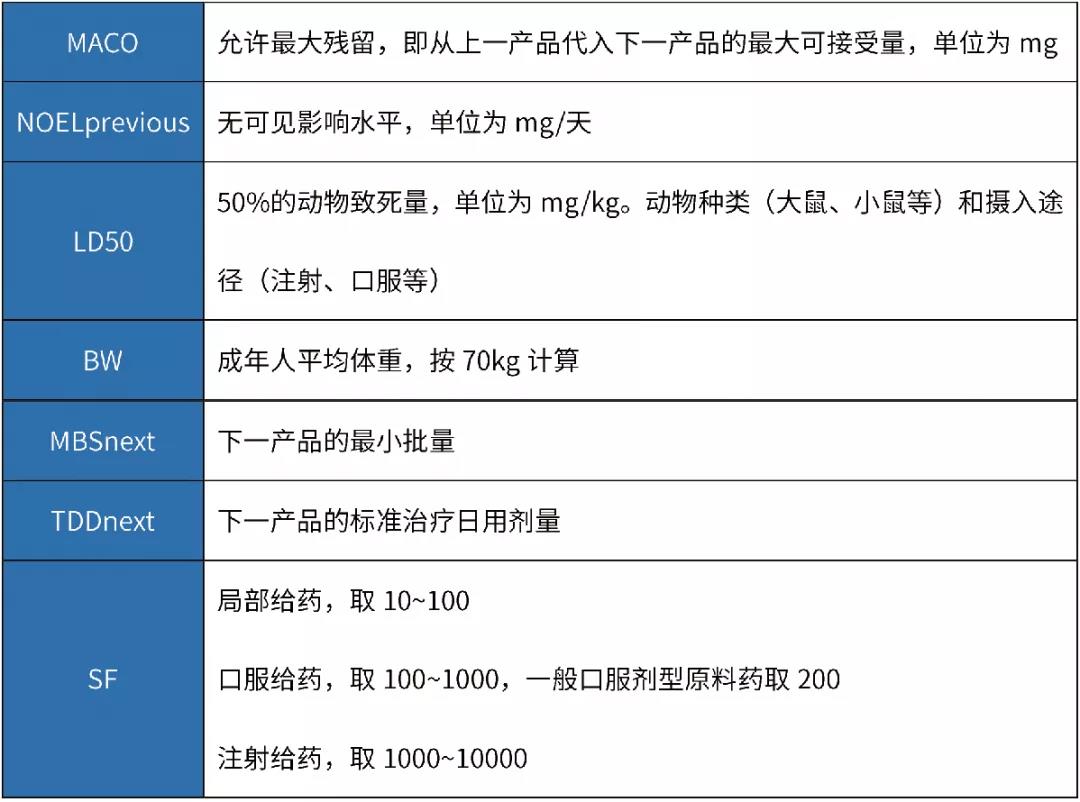
可利用以下公式,基于一個通用限度確定MACO限度,單位為ppm。
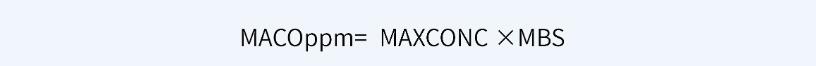
例如,就原料藥而言,通用限度為100ppm時,MACO為最小批量(MBS)的0.01%;通用限度為10ppm時,MACO為最小批量(MBS)的0.001%。
通過上述公式,確定MACO值后,即可通過如下公式,計算擦拭法及淋洗法的殘留可接受標準。
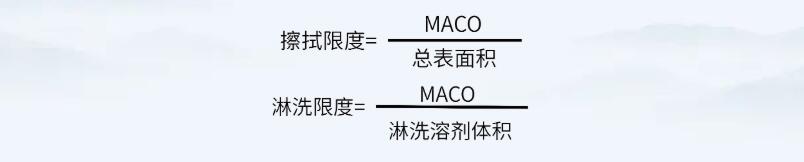
注意,上述公式中擦拭限度計算的“總表面積”可為共線產(chǎn)品共用設(shè)備的累積面積。
另外,關(guān)于一般限度10ppm,即10μg/ml或10mg/kg,對于液體制劑設(shè)備的清潔驗證標準確定,淋洗法限度即為10μg/ml。設(shè)下一批產(chǎn)品的生產(chǎn)批量為B(ml或kg),上批產(chǎn)品與下批產(chǎn)品的設(shè)備共用累積接觸面積為D(cm2),為確保安全,應(yīng)除以安全因子F(可依據(jù)藥物生理活性水平確定,通常分為1000、100、10三個級別),可按照如下過程計算擦拭法殘留限度Ld。
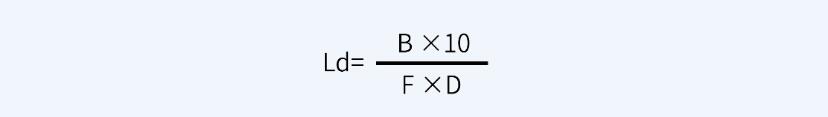
根據(jù)各公司所生產(chǎn)產(chǎn)品的屬性不同(例如,毒性、藥物活性等),從上一產(chǎn)品帶入下一產(chǎn)品中的污染物質(zhì)最大濃度通用上限通常設(shè)定為5~500ppm(原料藥設(shè)定為100ppm較為常見,注射劑可設(shè)定為10ppm)。
以上主要給出了4種藥物殘留限度的計算標準,其中第一種(基于健康數(shù)據(jù))及第三種(基于半數(shù)致死量)方法更為科學(xué),但因ADE、PDE值或LD50值難以明確,故用之較少,而第二種(基于日治療劑量)及第四種(基于一般限度)方法更為常用。因此,在確定殘留限度時,應(yīng)綜合評比上述幾種方法,基于最大程度上降低交叉污染的原則,選擇最為合適的結(jié)果作為清潔驗證的最終可接受標準。
在正式開展清潔驗證之前,需進行針對性分析方法的開發(fā)與驗證。通常選擇靈敏度較高的方法,如高效液相色譜法、氣相色譜法、紫外分光光度法等。首選可定量的檢測方法,也可選擇限度檢測方法。一般情況下,可以直接選擇待清潔品種質(zhì)量標準中規(guī)定的含量測定方法。所選用的分析方法均需按照《中國藥典》(2020年版)四部通則9101 分析方法驗證指導(dǎo)原則進行驗證。
制劑清潔驗證分析方法主要驗證項目及可接受標準如下:
擦拭法清潔驗證分析方法驗證
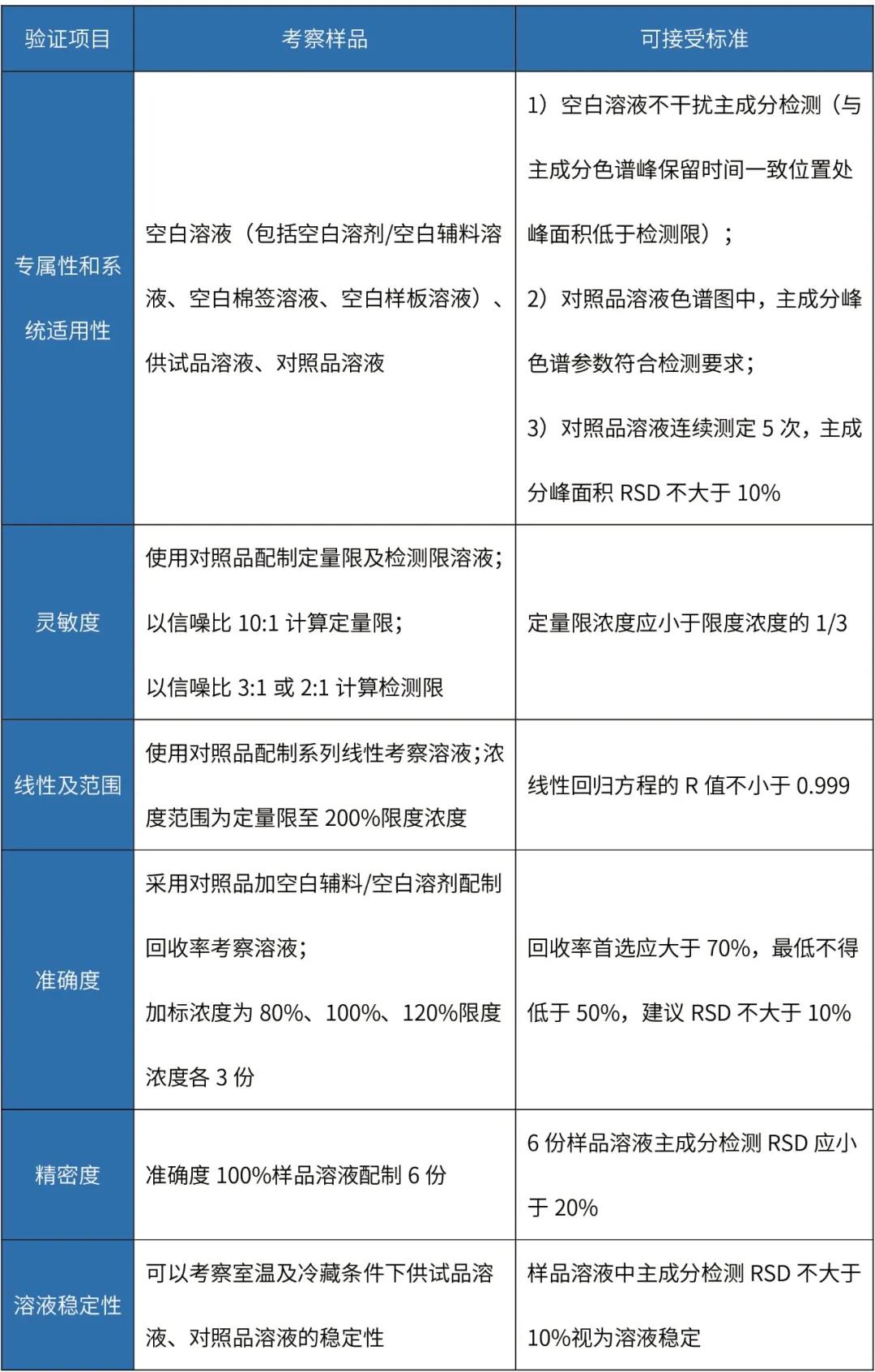
備注:
-
擦拭法準確度試驗樣品回收過程:將配制好的回收率考察溶液,定量添加至取樣板表面(根據(jù)設(shè)備情況確定取樣板材質(zhì),規(guī)格通常為5cm×5cm),使取樣板風(fēng)干,按照擬定方法用棉簽擦拭取樣板表面,照供試品溶液制備方法制備樣品溶液。
-
擦拭取樣操作方法:用溶劑潤濕藥簽,并將其靠在溶劑瓶邊擠壓,以去除多余的溶劑。將藥簽頭按在取樣表面上,用力使其稍彎曲,平穩(wěn)而緩慢地擦拭取樣表面,在向前移動的同時,將其從一邊移動到另一邊。擦拭的過程應(yīng)覆蓋整個取樣表面,然后翻轉(zhuǎn)藥簽,讓其另一側(cè)也進行擦拭,但其方向應(yīng)與前次垂直。
擦拭法取樣藥簽擦拭方法示例如下圖所示:

藥簽擦拭取樣示意圖
表 淋洗法清潔驗證分析方法驗證
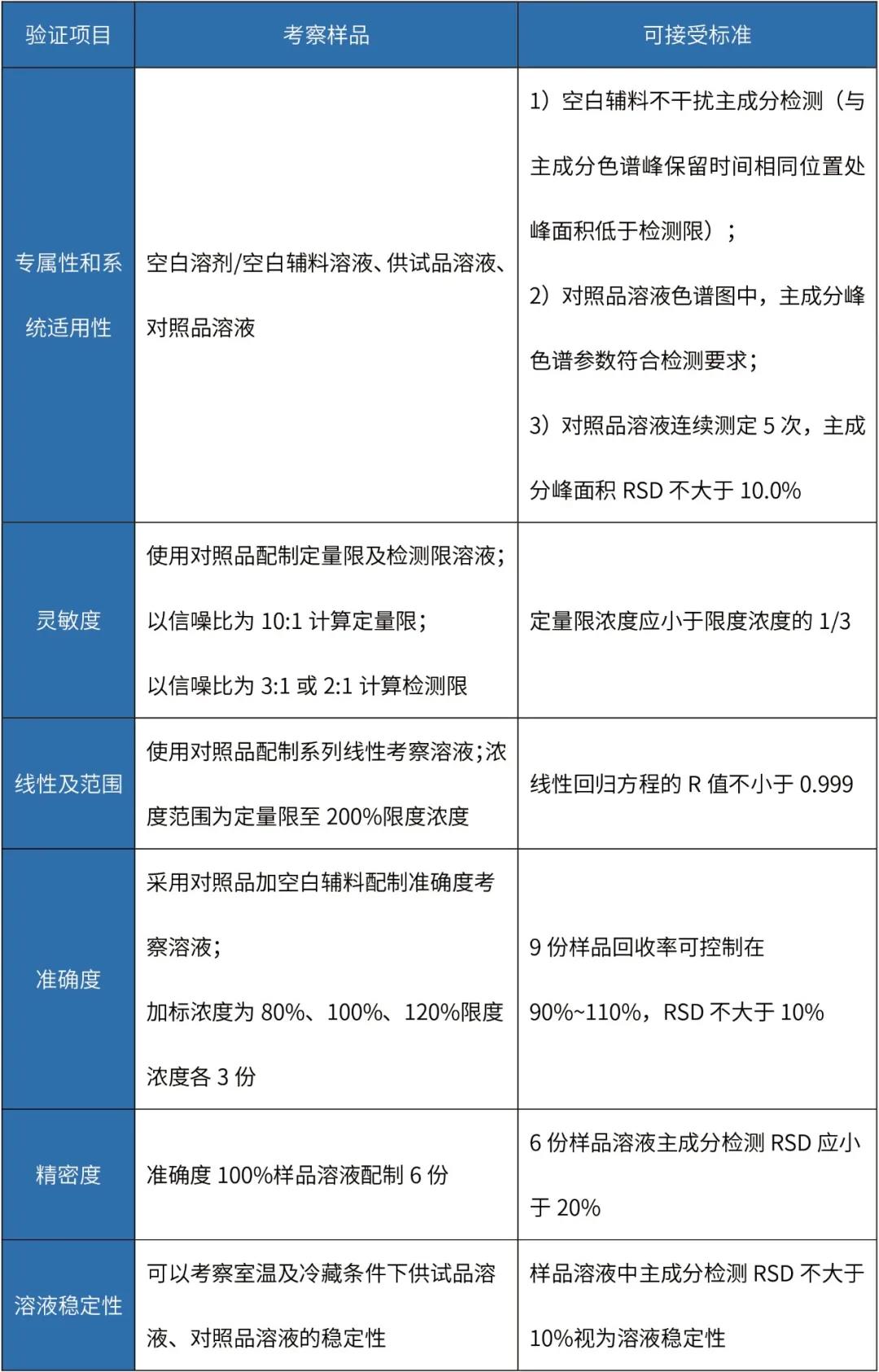
注:該表中淋洗法準確度試驗考察的是檢測方法的準確度,并非淋洗回收率,接受標準可依據(jù)限度酌情調(diào)整。
A注射液清潔驗證殘留限度確認過程如下:
無法獲得該注射液有效成分的ADE值或PDE值。
全部共線產(chǎn)品中,B注射液的日用劑量最大,折算成體積為24ml,其最小生產(chǎn)批量為200L;共用設(shè)備累積接觸面積為367380cm²。
? 計算方法一:基于日治療劑量的可接受標準(先生產(chǎn)A產(chǎn)品,再生產(chǎn)B產(chǎn)品)

其中:
-
MACO代表產(chǎn)品A能進入到產(chǎn)品B中的最大可接受量(mg);
-
MBS代表B產(chǎn)品的最小批量(ml或g);
-
TDDprevious代表A產(chǎn)品的日最小治療劑量(mg);
-
TDDnext代表在設(shè)備中生產(chǎn)B產(chǎn)品的最大日劑量(ml或g);
-
SF代表安全系數(shù),可取1000。
注:MBS與TDDnext單位應(yīng)統(tǒng)一。
對于本產(chǎn)品而言,產(chǎn)品A最小治療劑量按50mg計,產(chǎn)品B最小批量200000ml,最大日劑量為24ml。因此A注射液的有效成分能進入到B注射液中而不致引起風(fēng)險的最大量為:
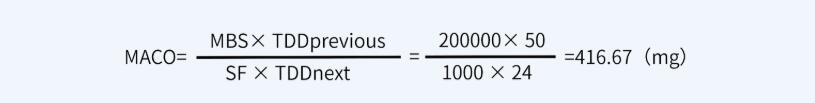
淋洗水按200L計,則淋洗水殘留限度416.67mg÷200L=2.083μg/ml
共用設(shè)備累積接觸面積為367380cm²,
則擦拭殘留限度為416.67mg÷367380cm²=1.134μg/ cm²
? 計算方法二:基于半數(shù)致死量的可接受標準(先生產(chǎn)A產(chǎn)品,再生產(chǎn)B產(chǎn)品)
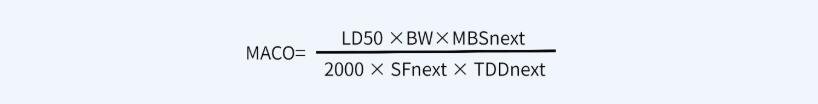
其中:
-
MACO代表產(chǎn)品A能進入到產(chǎn)品B中的最大可接受量(mg);
-
MBS表產(chǎn)品B的最小批量(ml或g);
-
TDDnext代表產(chǎn)品B的最大日劑量(ml或g);
-
SF代表安全系數(shù),一般取1000;
-
LD50代表動物的半數(shù)致死量,證明動物(如小鼠)和給藥途徑(如靜注\口服)很重要(mg/kg);
-
BW代表一個成年人的平均體重,按70kg計算;2000代表一個經(jīng)驗常數(shù)。
注:MBSnext與TDDnext單位應(yīng)統(tǒng)一。
對于本產(chǎn)品而言,產(chǎn)品A的小鼠半數(shù)致死量按照156mg/kg(靜脈注射)計,產(chǎn)品B的最小批量為200000ml,最大日劑量為24ml。因此A注射液的有效成分能進入到B注射液中而不致引起風(fēng)險的最大量為:
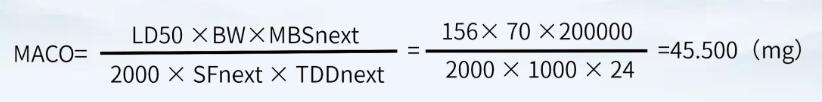
淋洗水按200L計,則淋洗水殘留限度
45.500mg÷200L =0.228μg/ml
共用設(shè)備累積接觸面積為367380cm²,
則擦拭殘留限度為45.500mg÷367380cm²=0.124μg/ cm²
? 計算方法三:一般限度,采用上批產(chǎn)品對下批產(chǎn)品的污染不得超過10ppm(10mg/kg)作為限定指標
最小批量200L,共用設(shè)備累積面積為367380cm²
淋洗法限度:10ppm=0.001%=0.001g/100ml=10μg/ ml
擦拭法限度:
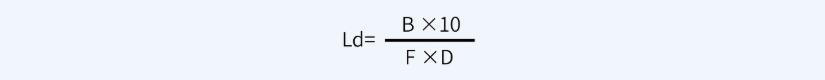
其中:
-
B代表B產(chǎn)品的最小批量(ml);
-
D代表共用設(shè)備累積面積(cm2);
-
F代表安全因子,一般取10。
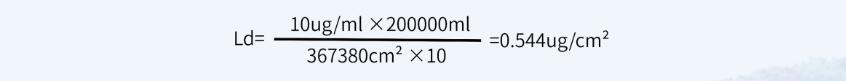
采用上述3種計算方法中結(jié)果最小的限度值,即擦拭法殘留限度不得過0.124μg/ cm²,淋洗法殘留限度不得過0.228μg/ml。
清潔驗證是防止藥品生產(chǎn)過程中發(fā)生污染與交叉污染的重要措施之一,企業(yè)應(yīng)針對藥品特性、生產(chǎn)設(shè)備特點等因素建立明確可控的清洗程序,并依據(jù)科學(xué)分析制定合理的殘留限度標準,建立并驗證科學(xué)的取樣及分析方法,以確保驗證結(jié)果準確,藥品生產(chǎn)穩(wěn)定可控,藥品質(zhì)量安全可靠。
-END-
關(guān)于我們:
北京新領(lǐng)先(股票代碼:600222)成立于2005年,是一家面向全球提供藥學(xué)臨床前研究、臨床CRO和CDMO服務(wù)的高新技術(shù)企業(yè),連續(xù)多年蟬聯(lián)“中國醫(yī)藥研發(fā)公司榜首”。公司總部位于北京中關(guān)村高新技術(shù)園區(qū),同時在鄭州臨空生物園區(qū)建立了新藥篩選及檢測平臺、藥物評價平臺(動物房,GLP、AAALAC、CNAS認證)、大分子中試及大規(guī)模生產(chǎn)服務(wù)平臺、小分子CMC制劑研究生產(chǎn)平臺、細胞技術(shù)服務(wù)平臺和臨床CRO平臺等六大符合國際標準(FDA、EMA和NMPA GMP標準)的研發(fā)平臺,形成“新領(lǐng)先CXO”全產(chǎn)業(yè)鏈服務(wù)體系。仿創(chuàng)結(jié)合,雙引擎驅(qū)動,能夠為客戶提供藥學(xué)研發(fā)全生命周期的多元化服務(wù)。


轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-61006450
Hotline服務(wù)熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場部:
技術(shù)市場部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
