解讀 | 分析方法學(xué)驗(yàn)證、轉(zhuǎn)移和確認(rèn)的關(guān)鍵指標(biāo)
為證明所采用的分析方法是否適合于相應(yīng)檢測要求和目的,被測樣品質(zhì)量是否可控,保證得到一致、可靠和準(zhǔn)確的測定結(jié)果,檢測人員是否有能力操作分析方法,進(jìn)行化學(xué)藥品分析方法的驗(yàn)證、轉(zhuǎn)移和確認(rèn)。
(method validation)
實(shí)驗(yàn)室通過試驗(yàn)設(shè)計(jì)和測試,對方法學(xué)參數(shù)進(jìn)行全面的驗(yàn)證,以證明方法適用于擬定檢驗(yàn)用途。
由方法建立者進(jìn)行,即誰建立方法誰負(fù)責(zé)驗(yàn)證,方法建立者必須要證明所建立的方法能滿足期望的檢測用途。
由方法建立者進(jìn)行,即誰建立方法誰負(fù)責(zé)驗(yàn)證,方法建立者必須要證明所建立的方法能滿足期望的檢測用途。
表1 不同國際組織和藥典要求的方法學(xué)驗(yàn)證參數(shù)
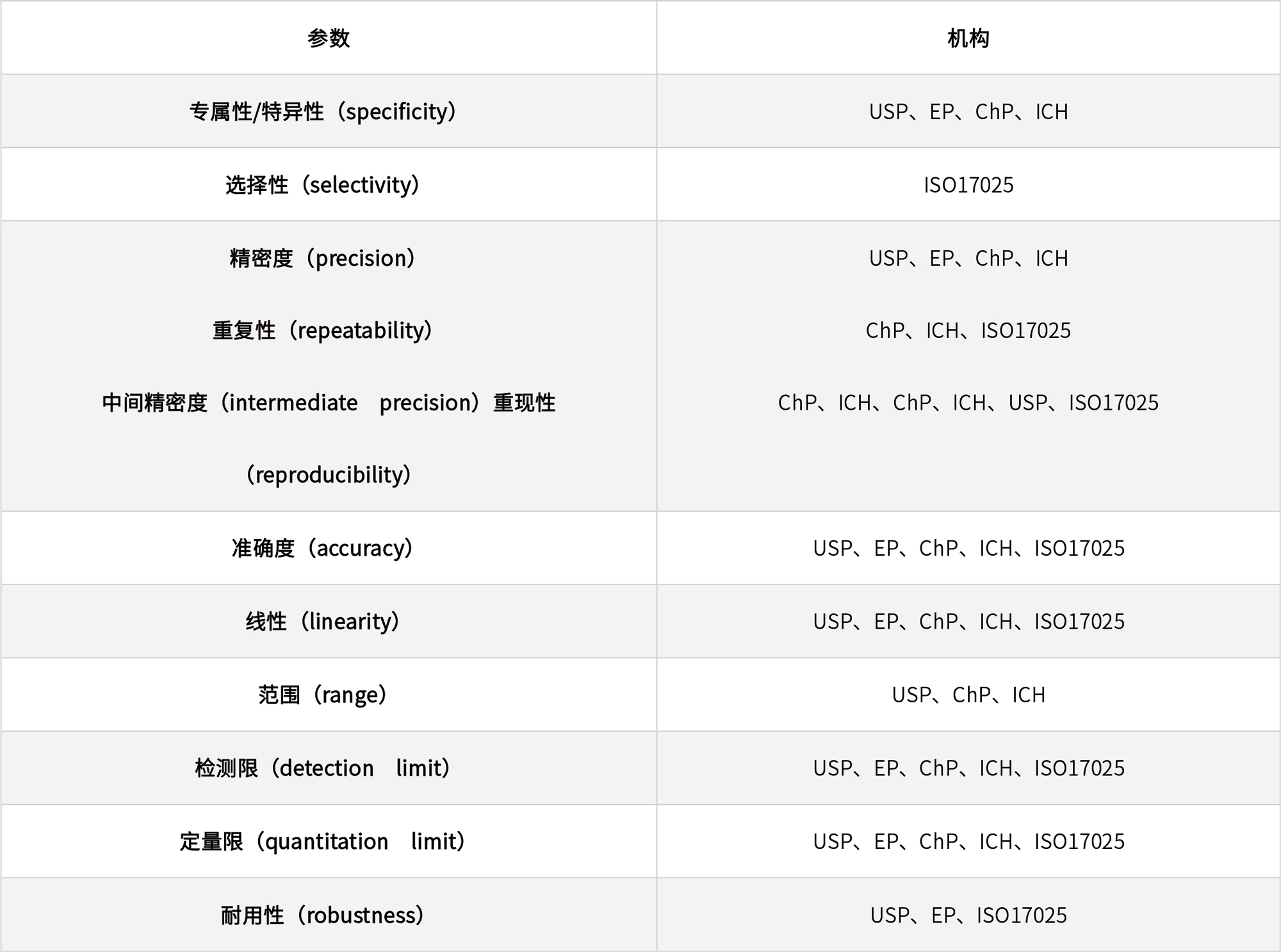
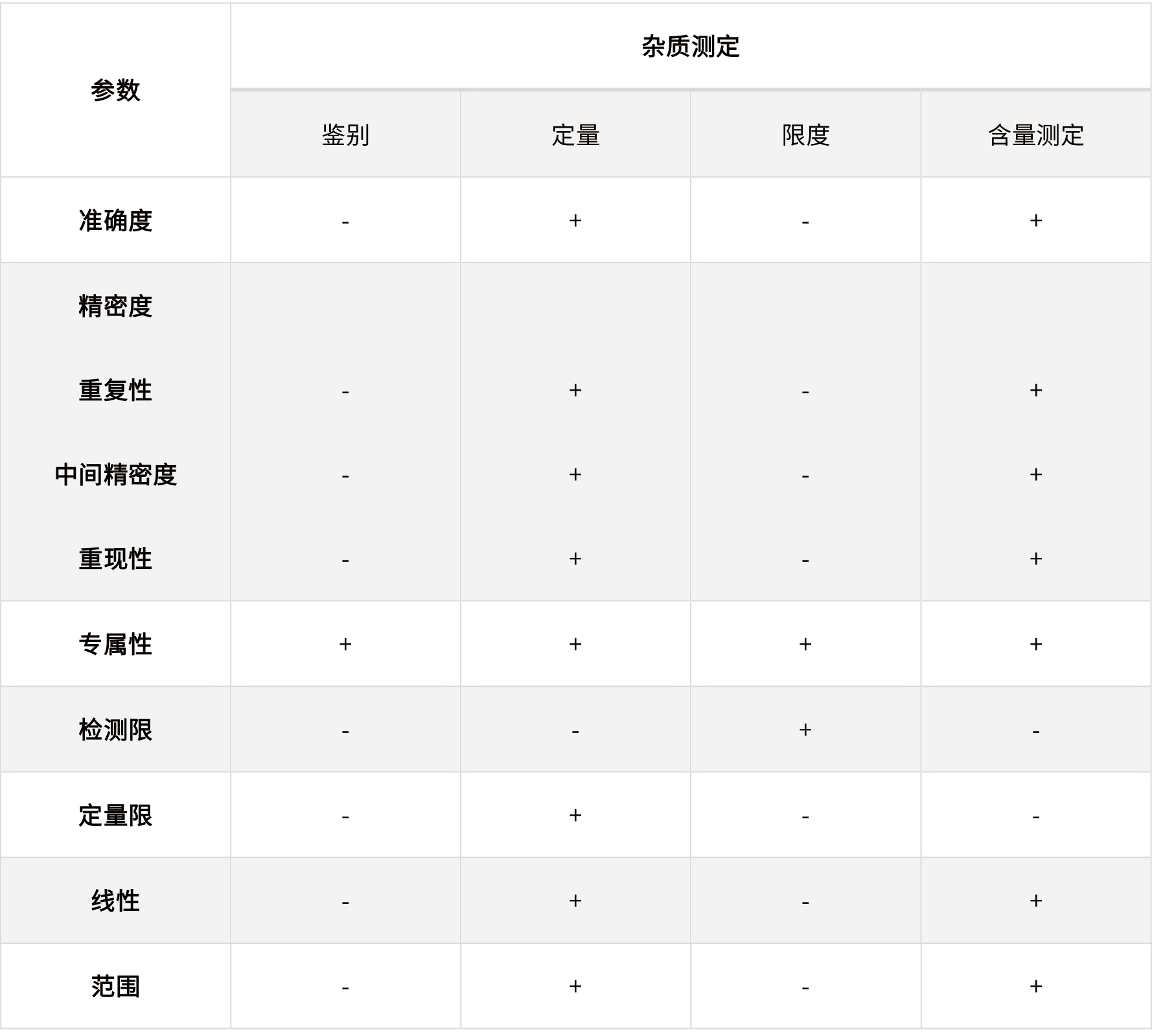
表2 ICH指導(dǎo)原則中規(guī)定的不同檢驗(yàn)?zāi)康男枰?yàn)證的參數(shù)
(method transfer)
一個實(shí)驗(yàn)室建立好分析方法并經(jīng)過驗(yàn)證后,當(dāng)其他實(shí)驗(yàn)室(方法接收實(shí)驗(yàn)室)在使用這個方法進(jìn)行檢驗(yàn)檢測時,這就牽涉到方法在兩個不同實(shí)驗(yàn)室之間的轉(zhuǎn)移問題,接收方法的實(shí)驗(yàn)室需要證明其能夠成功的在本實(shí)驗(yàn)室中運(yùn)行該方法。
? 通過比對檢驗(yàn)進(jìn)行方法轉(zhuǎn)移:1批或多批次樣品檢測結(jié)果;
? 通過共同驗(yàn)證進(jìn)行方法轉(zhuǎn)移:分析方法的驗(yàn)證和轉(zhuǎn)移合并一起同時驗(yàn)證;
? 通過再驗(yàn)證進(jìn)行方法轉(zhuǎn)移:接收實(shí)驗(yàn)室重復(fù)部分或所有的方法學(xué)驗(yàn)證試驗(yàn);
? 由于X公司購買了Y公司的的產(chǎn)品,方法由Y公司轉(zhuǎn)移到X公司。
? 由公司的研發(fā)實(shí)驗(yàn)室轉(zhuǎn)移到質(zhì)控實(shí)驗(yàn)室;
? 生產(chǎn)線轉(zhuǎn)移使分析方法由A生產(chǎn)地點(diǎn)轉(zhuǎn)移到B生產(chǎn)地點(diǎn);
? 由CRO公司轉(zhuǎn)移到合同公司;
? 通過免除試驗(yàn)進(jìn)行方法轉(zhuǎn)移:不預(yù)先進(jìn)行檢驗(yàn)結(jié)果比對而直接進(jìn)行正式檢驗(yàn)(一定要有記錄并說明原因)。
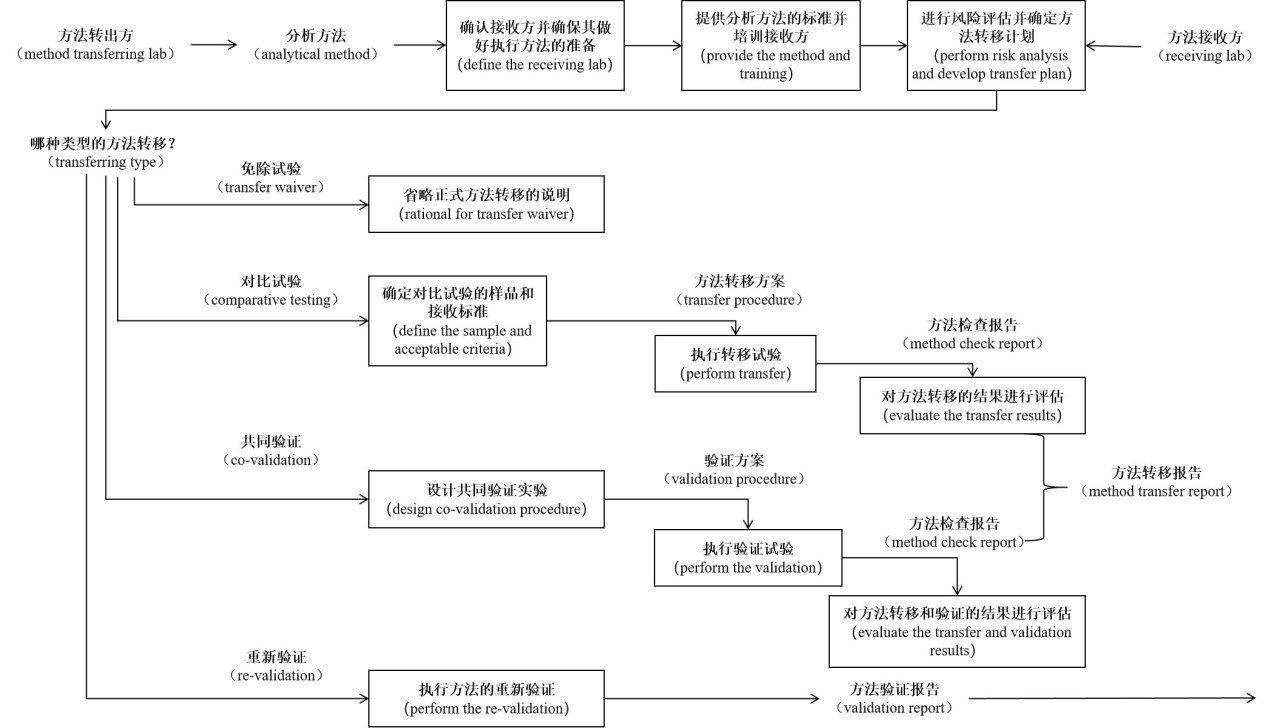
表3 通過比對試驗(yàn)進(jìn)行某樣品(原料或制劑)相關(guān)分析方法轉(zhuǎn)移的接收標(biāo)準(zhǔn)事例
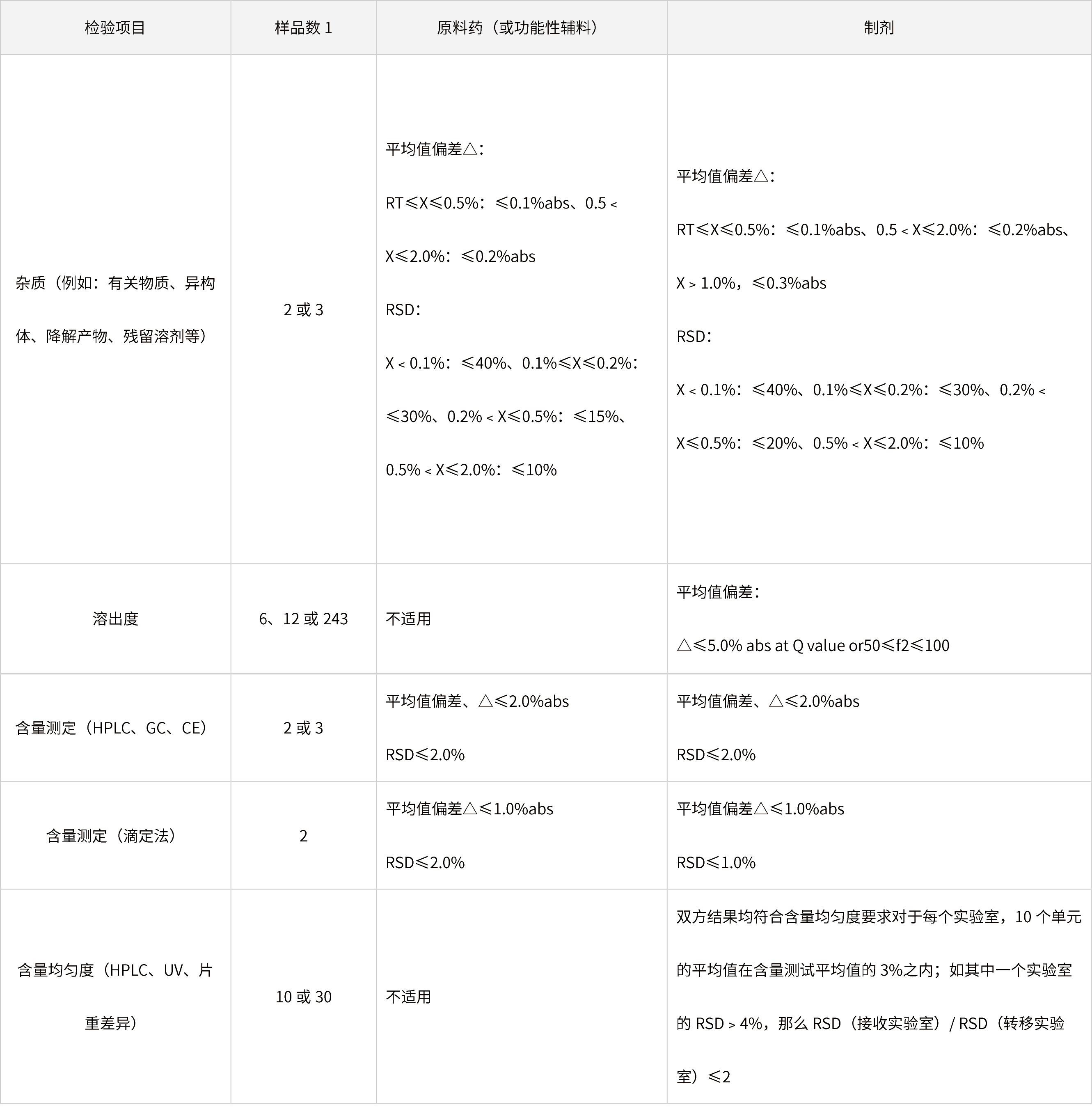
備注:
(1)△:轉(zhuǎn)出實(shí)驗(yàn)室和接收實(shí)驗(yàn)室的平均值絕對偏差;
(2)RT:報(bào)告閾值(report threshold value);
(3)2:中間精密度,如n=4,則是在轉(zhuǎn)移實(shí)驗(yàn)室和接收實(shí)驗(yàn)室進(jìn)行的2個重復(fù)測定的相對標(biāo)準(zhǔn)偏差;
(4)3:根據(jù)USP、EP和JP制定;
(5)上表列舉的接收標(biāo)準(zhǔn)會因樣品規(guī)格、生產(chǎn)工藝、分析方法以及產(chǎn)品的質(zhì)量標(biāo)準(zhǔn)而變化。
方法轉(zhuǎn)移報(bào)告由接收實(shí)驗(yàn)室的檢測人員匯總轉(zhuǎn)出實(shí)驗(yàn)室和接收實(shí)驗(yàn)室的檢測結(jié)果,并根據(jù)方法轉(zhuǎn)移方案中的接收標(biāo)準(zhǔn)對整個方法轉(zhuǎn)移做出評估和總結(jié)。如分析方法需要進(jìn)行任何變更,轉(zhuǎn)出實(shí)驗(yàn)室應(yīng)在方法轉(zhuǎn)移總結(jié)報(bào)告中提出分析方法變更的細(xì)節(jié)和評估變更后的方法是否需要驗(yàn)證。如果是共同驗(yàn)證或再驗(yàn)證,接收實(shí)驗(yàn)室的結(jié)果由轉(zhuǎn)出實(shí)驗(yàn)室的檢測人員根據(jù)最后階段驗(yàn)證報(bào)告進(jìn)行核對。共同驗(yàn)證的結(jié)果須放在方法轉(zhuǎn)移報(bào)告中,保證可追溯性。
如果接收實(shí)驗(yàn)室需要使用不同的供試品溶液制備方法,如使用自動樣品制備系統(tǒng)代替手動樣品制備,方法轉(zhuǎn)移中需要說明這個變化仍能適用于實(shí)驗(yàn)?zāi)康牡睦碛桑兓a(chǎn)生的相關(guān)結(jié)果和結(jié)論需要在方法轉(zhuǎn)移報(bào)告中詳細(xì)記錄。
轉(zhuǎn)出實(shí)驗(yàn)室和所有參與的接收實(shí)驗(yàn)室都要審核方法轉(zhuǎn)移報(bào)告并由所有相關(guān)實(shí)驗(yàn)室的審核部門批準(zhǔn)。
轉(zhuǎn)移報(bào)告可能包括以下內(nèi)容:被測樣品名稱;轉(zhuǎn)移的分析方法(名稱、版本);方法轉(zhuǎn)移方案;接收實(shí)驗(yàn)室人員的培訓(xùn)記錄;責(zé)任(如方法轉(zhuǎn)移報(bào)告的審核和批準(zhǔn));轉(zhuǎn)移中使用的儀器、器具和試劑;轉(zhuǎn)出實(shí)驗(yàn)室和接收實(shí)驗(yàn)室的檢測結(jié)果;評估方法轉(zhuǎn)移報(bào)告中的偏差及異常結(jié)果的調(diào)查;根據(jù)接收標(biāo)準(zhǔn)評估數(shù)據(jù);后續(xù)的工作安排(如果適用);總結(jié)和結(jié)論。
(method verification)
根據(jù)方法的用途和方法的復(fù)雜程度,選擇性地選擇對檢測結(jié)果影響最大的關(guān)鍵方法學(xué)參數(shù)進(jìn)行考察。
? 必須是對藥典分析方法或法定分析方法進(jìn)行確認(rèn);
? 證明藥典分析方法或法定分析方法適用于被測樣品,被測樣品的質(zhì)量可控,方法可行;
? 證明方法使用人員有能力成功的操作藥典分析方法或者法定分析方法。
一般來說,如果沒有特別說明不適用測定某個樣品,藥典中所收載的基本檢驗(yàn)方法不要求進(jìn)行方法確認(rèn)。這些基本檢驗(yàn)方法包括:干燥失重、熾灼殘?jiān)⒅亟饘佟岱治龇ǖ龋约案鞣N濕法化學(xué)分析(比如酸值測定)和用簡單的儀器進(jìn)行檢驗(yàn)(如pH測定)等。
參考?xì)W洲OMCL的《分析方法驗(yàn)證》、AOAC的《如何達(dá)到ISO 17025對方法確認(rèn)的要求》以及《美國藥典》附錄1206,并結(jié)合我國藥品檢驗(yàn)實(shí)際工作內(nèi)容,把常規(guī)藥品檢驗(yàn)方法按照被測化合物的濃度高低分為3類,列出了方法確認(rèn)內(nèi)容具體要求,以期為廣大藥品監(jiān)管和檢驗(yàn)工作者提供一個具體的參考。
? 鑒別檢查:目的在于判斷被測物是否是目標(biāo)檢測物。
表4 鑒別檢查
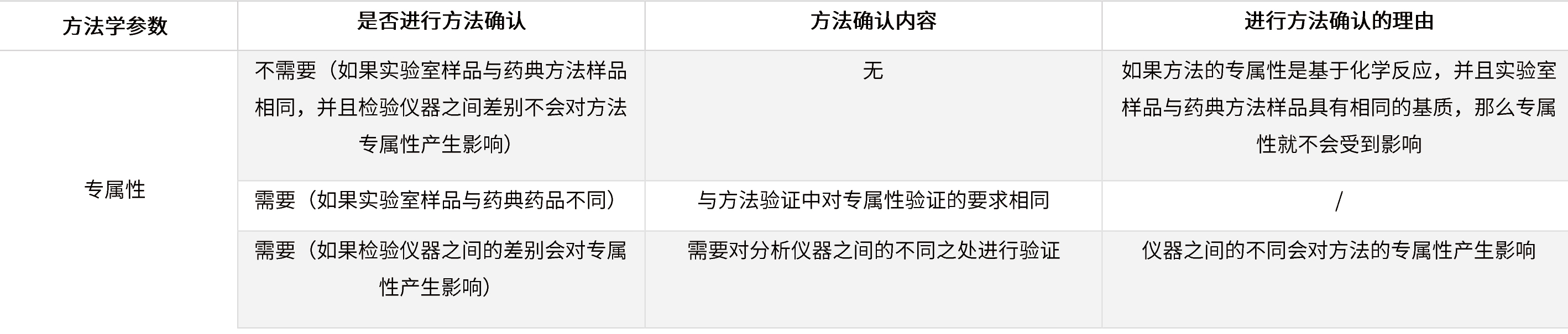
? 被測物濃度在定量限附近的限度檢查(殘留溶劑/有關(guān)物質(zhì)/致突變雜質(zhì)等)
表5 在定量限附近的限度檢查
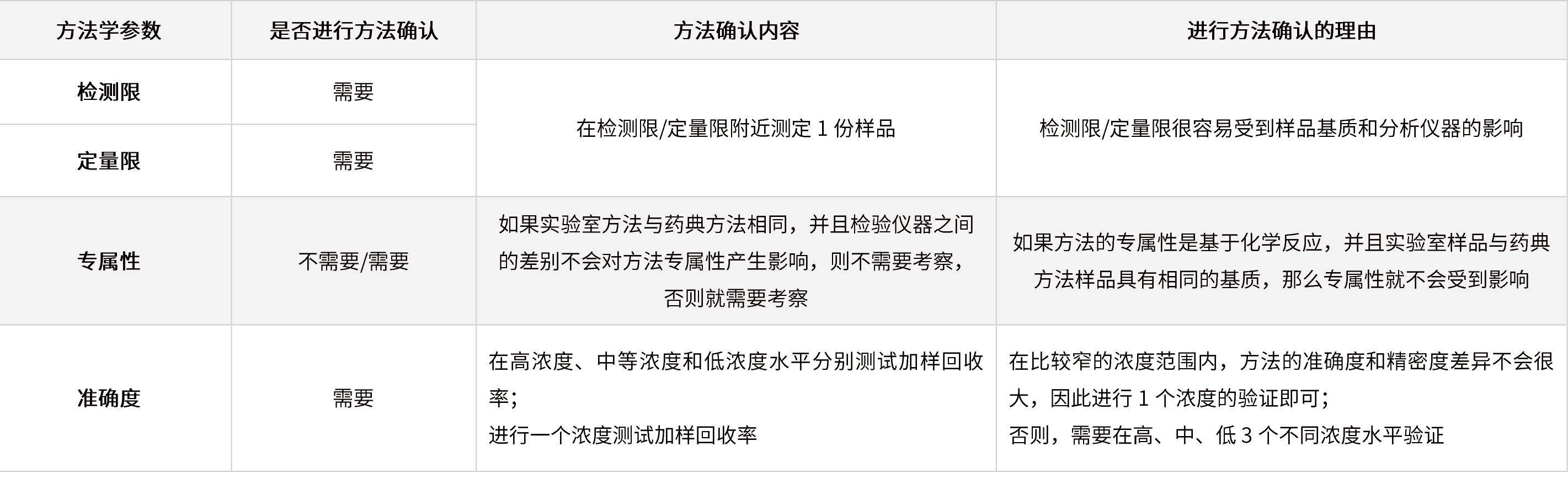
? 較高濃度的限度檢查和含量測定(含量/含量均勻度/溶出度等)
表6 在較高濃度的限度檢查和含量測定
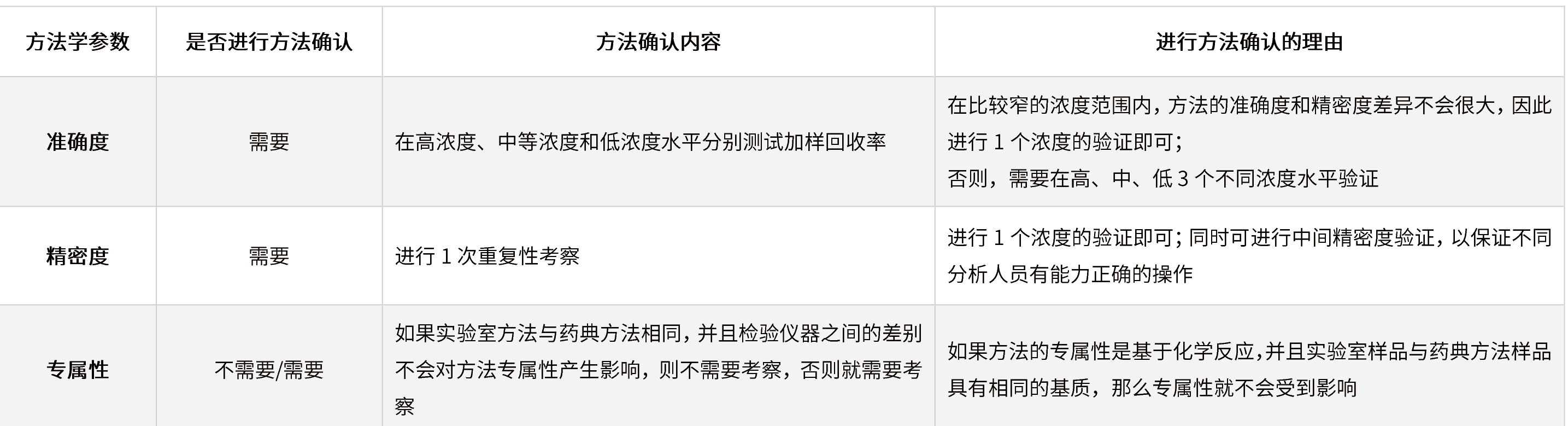
? 其他:實(shí)驗(yàn)室和方法確認(rèn)的有關(guān)文件應(yīng)該包括:①確認(rèn)計(jì)劃;②被確認(rèn)方法的詳細(xì)描述;③需要進(jìn)行確認(rèn)的方法學(xué)參數(shù)的詳細(xì)描述;④確認(rèn)結(jié)果的判斷標(biāo)準(zhǔn);⑤對偏差的合理解釋。
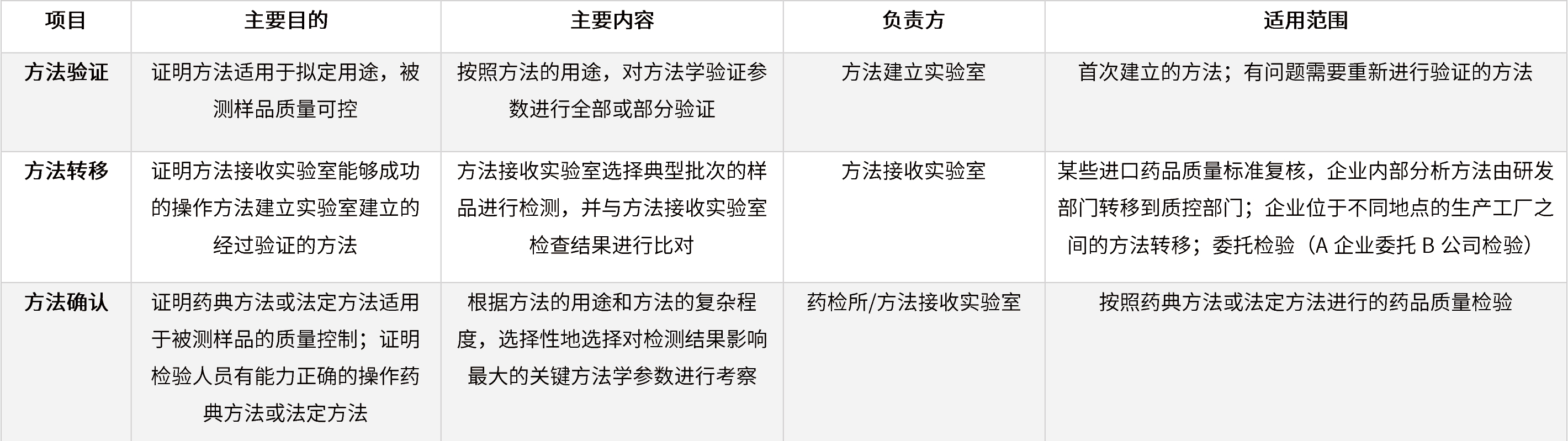
表7 方法驗(yàn)證、方法轉(zhuǎn)移和方法確認(rèn)的聯(lián)系與區(qū)別
參考文獻(xiàn)
【1】2019年版中國藥品檢驗(yàn)標(biāo)準(zhǔn)操作規(guī)范
【2】2020年版中國藥典
【3】ISO 17025
【4】ICH Q2分析方法的驗(yàn)證
-END-
關(guān)于我們:
北京新領(lǐng)先(股票代碼:600222)成立于2005年,是一家面向全球提供藥學(xué)臨床前研究、臨床CRO和CDMO服務(wù)的高新技術(shù)企業(yè),連續(xù)多年被評為“中國醫(yī)藥研發(fā)公司10強(qiáng)(2019年位列第一)”。公司總部位于北京中關(guān)村高新技術(shù)園區(qū),同時在鄭州臨空生物園區(qū)建立了新藥篩選及檢測平臺、藥物評價平臺(動物房,GLP、AAALAC、CNAS認(rèn)證)、大分子中試及大規(guī)模生產(chǎn)服務(wù)平臺、小分子CMC制劑研究生產(chǎn)平臺、細(xì)胞技術(shù)服務(wù)平臺和臨床CRO平臺等六大符合國際標(biāo)準(zhǔn)(FDA、EMA和NMPA GMP標(biāo)準(zhǔn))的研發(fā)平臺,形成“新領(lǐng)先CXO”全產(chǎn)業(yè)鏈服務(wù)體系。仿創(chuàng)結(jié)合,雙引擎驅(qū)動,能夠?yàn)榭蛻籼峁┧帉W(xué)研發(fā)全生命周期的多元化服務(wù)。


轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-61006450
Hotline服務(wù)熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場部:
技術(shù)市場部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
