政策法規(guī)||本周重磅政策法規(guī)概覽(21.06.28-21.07.02)
NMPA/CDE/CFDI/藥典委公布藥品相關內(nèi)容本周集錦。
01
本周共計66個品種獲批取得藥品批準證明文件,其中一致性評價品種10個,包括注射劑品種4個。


關于公布《免于經(jīng)營備案的第二類醫(yī)療器械產(chǎn)品目錄》的公告(2021年第86號)
為貫徹實施《醫(yī)療器械監(jiān)督管理條例》,國家藥監(jiān)局組織制定了《免于經(jīng)營備案的第二類醫(yī)療器械產(chǎn)品目錄》,現(xiàn)予以公布。包括電子血壓計、水銀血壓表等13個產(chǎn)品。

掃描下方二維碼
查看詳細信息

關于發(fā)布視力篩查儀和乳腺X射線系統(tǒng)2項注冊技術審查指導原則的通告(2021年第42號)
為加強醫(yī)療器械產(chǎn)品注冊工作的監(jiān)督和指導,進一步提高注冊審查質(zhì)量,國家藥品監(jiān)督管理局組織制定了《視力篩查儀注冊技術審查指導原則》和《乳腺X射線系統(tǒng)注冊技術審查指導原則》,現(xiàn)予發(fā)布。

掃描下方二維碼
查看詳細信息

關于實施中國藥品監(jiān)管科學行動計劃第二批重點項目的通知
為貫徹落實《國務院辦公廳關于全面加強藥品監(jiān)管能力建設的實施意見》(國辦發(fā)〔2021〕16號),加快推動中國藥品監(jiān)管科學行動計劃實施,在系統(tǒng)總結首批監(jiān)管科學重點項目實施情況的基礎上,經(jīng)國家藥監(jiān)局局長辦公會議審議通過,現(xiàn)發(fā)布中國藥品監(jiān)管科學行動計劃第二批重點項目。
本批重點項目執(zhí)行周期原則上為2年。合作單位原則上依托國家藥監(jiān)局監(jiān)管科學研究基地和重點實驗室。項目實施方案請于7月20日前報科技和國際合作司。

掃描下方二維碼
查看詳細信息

關于發(fā)布《化學仿制藥參比制劑目錄(第四十六批)》的公示
本批公布共計57個品規(guī)的參比制劑來源,其中新增補27個;并且12個品種未通過審議,原因主要集中于擬申請參比制劑缺乏完整充分的有效性數(shù)據(jù)、不具有參比制劑地位等。其中首次包含了《已發(fā)布化學仿制藥參比制劑調(diào)出品種目錄》,共9個品規(guī)。

掃描下方二維碼
查看詳細信息

關于公開征求《以臨床價值為導向的抗腫瘤藥物臨床研發(fā)指導原則》意見的通知
為落實以臨床價值為導向,以患者需求為核心的研發(fā)理念,促進抗腫瘤藥科學有序的開發(fā),藥品審評中心組織撰寫了《以臨床價值為導向的抗腫瘤藥物臨床研發(fā)指導原則》,形成征求意見稿。目前我國抗腫瘤藥物研發(fā)處于快速發(fā)展階段;腫瘤患者對于藥物的安全性、治療體驗和生存質(zhì)量都有了更高的期望。抗腫瘤藥物研發(fā),從確定研發(fā)方向,到開展臨床試驗,都應貫徹以臨床需求為核心的理念,開展以臨床價值為導向的抗腫瘤藥物研發(fā)。

掃描下方二維碼
查看詳細信息

關于公開征求《克羅恩病治療藥物臨床試驗技術指導原則》意見的通知
為進一步規(guī)范和指導克羅恩病治療藥物臨床試驗,提供可參考的技術規(guī)范,我中心起草了《克羅恩病治療藥物臨床試驗技術指導原則》,經(jīng)中心內(nèi)部討論,已形成征求意見稿。
本指導原則主要參考EMA 2018年發(fā)布的相關指導原則,以及IOIBD 2021年發(fā)表的SPIRIT共識和STRIDE-II共識等相關內(nèi)容起草。適用于成人和兒童克羅恩病治療藥物的臨床研發(fā),包括化學藥品和治療用生物制品。主要討論了臨床試驗設計的總體考慮和不同研發(fā)階段的重點關注內(nèi)容。僅作為推薦性建議。隨著科學研究的進展,本指導原則中的相關內(nèi)容將不斷完善與更新。

掃描下方二維碼
查看詳細信息

藥審中心召開古代經(jīng)典名方中藥復方制劑毒理研究技術研討會
針對古代經(jīng)典名方中藥復方制劑申報可能帶來的重復開展毒理學試驗問題,2021年6月16日,藥審中心藥理毒理學部組織召開了古代經(jīng)典名方中藥復方制劑毒理研究技術研討會,來自國內(nèi)十余家中醫(yī)藥企業(yè)的研究專家,以及GLP中心和藥物安全性評價相關專業(yè)委員會的毒理學專家參加了會議,對如何規(guī)范和引導此類產(chǎn)品合理開展非臨床安全性評價、促進研究和上市進行了研討。
與會專家著重討論了多家企業(yè)開發(fā)同一古代經(jīng)典名方制劑的情形,對是否有必要重復開展毒理學研究、毒理學研究資料能否共享以及如何合法共享等問題充分發(fā)表了意見和建議。與會專家明確了以企業(yè)為責任主體的研究資料共享和物質(zhì)基礎一致性評估,并提出了國家資金支持項目資源開放共享、企業(yè)自發(fā)形成研究評價聯(lián)盟和首家產(chǎn)品上市后相關信息公開等建設性意見;也有企業(yè)對研究資料共享表達了不同意見,包括知識產(chǎn)權、一致性基礎和實際操作難度等。

掃描下方二維碼
查看詳細信息

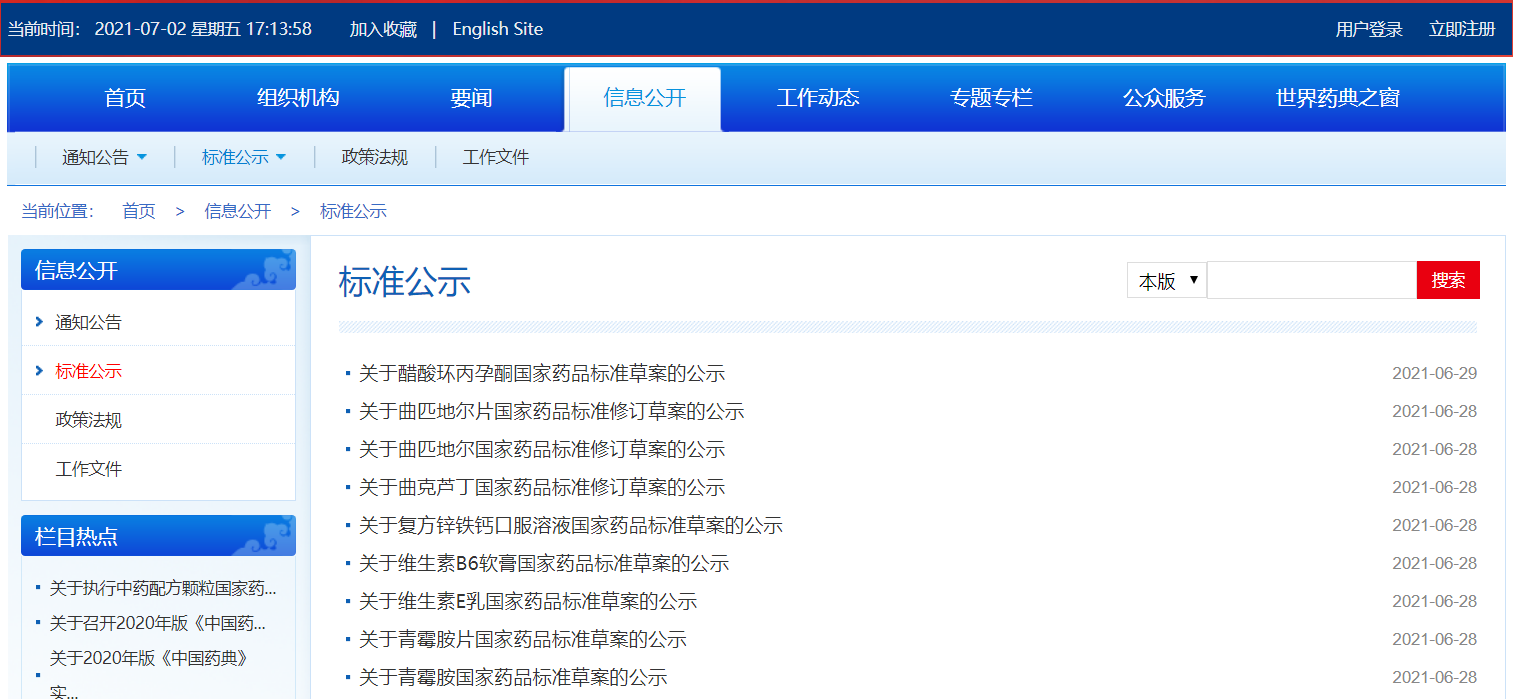
本周醋酸環(huán)丙孕酮、復方鋅鐵鈣口服溶液、維生素B6軟膏、維生素E乳、青霉胺片、青霉胺國家藥品標準草案公示;曲匹地爾、曲匹地爾片、曲克蘆丁國家藥品標準修訂草案公示。
掃描下方二維碼
查看詳細信息

-END-
關于我們:
藥政部是隸屬于公司副總裁直接領導下的部門,以國家藥品政策為導向,以為客戶提供集藥物研發(fā)、注冊申報、現(xiàn)場核查等一體化專業(yè)技術服務為宗旨,以高效、成功申報項目最終目標。
藥政部擁有一支技術與注冊經(jīng)驗豐富的團隊,作為一家提供專業(yè)服務的公司,在原料藥登記、仿制藥一致性評價、仿制藥注冊、新藥注冊以及進口藥品注冊等方面均具有專業(yè)且豐富的經(jīng)驗,已助力成功申報多項藥品注冊申請,在業(yè)內(nèi)具有良好的口碑。
部門堅持 “忠誠、思考、建設、承擔、分享”的公司理念,不斷加強人才隊伍建設、提升專業(yè)能力、豐富注冊經(jīng)驗、拓展業(yè)務范圍,致力于為客戶提供高效率、高質(zhì)量、合規(guī)的技術服務,為保護和促進公眾健康而不懈努力。


轉載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權利人授權使用作品的,應在授權范圍內(nèi)使用,并注明“來源:新領先醫(yī)藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
