一文盤點:TCR-T細胞免疫治療在腫瘤治療中的研究進展
前言
過繼性T細胞療法是癌癥免疫療法的一個分支,旨在利用T細胞的特異性和功能來對抗腫瘤,主要包括:腫瘤浸潤淋巴細胞(tumor-infiltrating lymphocytes, TILs)、嵌合抗原受體T細胞(chimeric antigen receptor modified T cells,CAR-T)以及工程化T細胞受體修飾的T細胞(T-cell receptor-engineered T cells,TCR-T)等。
通過將能夠特異性與抗原結合的TCR基因轉入T淋巴細胞,使其獲得與表達該抗原腫瘤細胞結合并誘發T細胞殺傷腫瘤細胞的能力。T細胞受體(TCRs)為T細胞提供識別信號,輔之以共刺激信號,該信號可以提供開/關信號來調節T細胞的激活。
T細胞受體是一種異二聚體,由兩條不同的跨膜多肽鏈組成:一條α鏈和一條β鏈,每一條都包含一個固定區域,固定T細胞表面膜內的鏈,以及一個可變區域,識別并結合MHC呈遞的抗原。額外的共刺激信號對T細胞功能的充分執行也是必不可少的,包括細胞毒性T細胞表面的CD8,它與I類MHC復合體結合,以及輔助性T細胞表面的CD4,它與II類MHC復合體結合[1]。
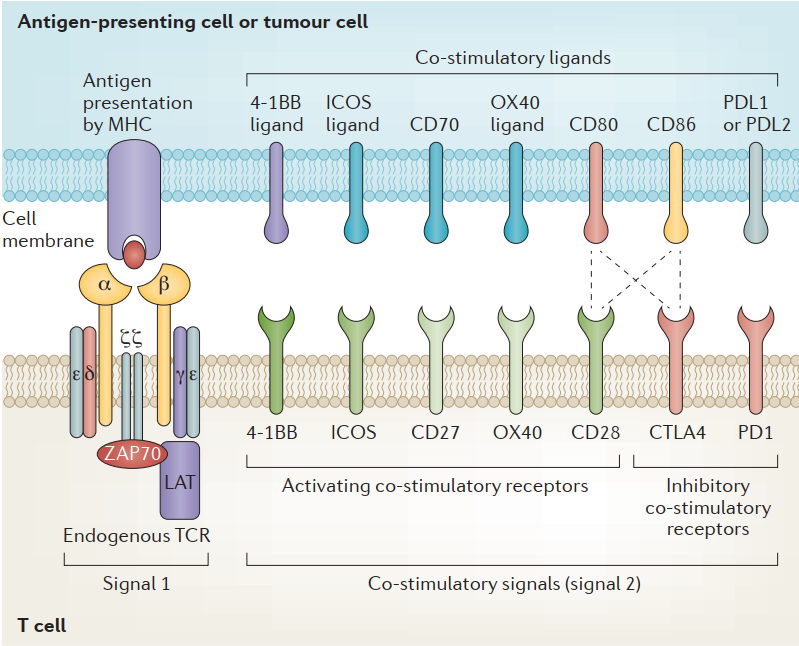
T細胞受體與T細胞的共刺激域 [2]
TCR-T與CAR-T作用機制的差異
目前,CAR-T在血液系統惡性腫瘤的臨床治療中效果顯著。由于實體腫瘤的免疫抑制腫瘤微環境和腫瘤細胞表面的腫瘤相關抗原表達率較低(1 - 10%)等因素,限制了CAR-T在實體腫瘤的臨床應用。
不同于CAR-T細胞只能識別細胞膜外的蛋白質,TCR-T細胞的主要優勢是能夠識別細胞外和細胞內的蛋白,而超過85%的細胞蛋白位于細胞內,所以對于實體瘤,TCR-T可以發揮更好的作用 [3]。
TCR的效力依賴于它與肽-主要組織相容性復合體(pMHC)的相互作用,pMHC即為肽結合于MHC形成的復合物。來自T細胞的TCR必須與患者的人類白細胞抗原(HLA)等位基因匹配,識別這些pMHC并殺傷癌細胞[1]。
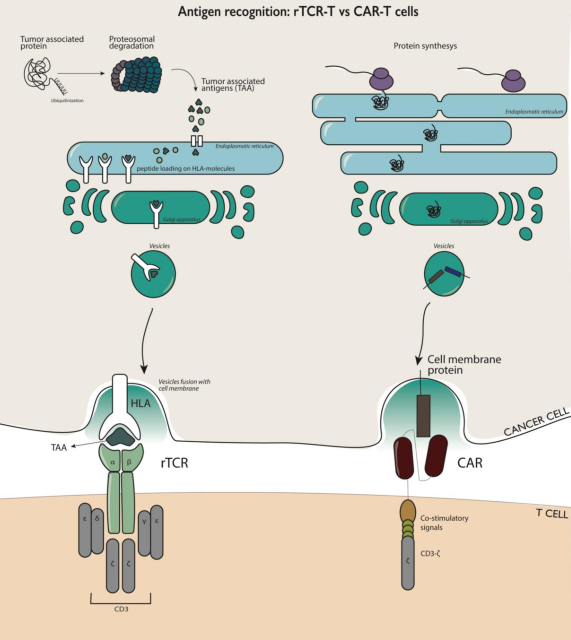
TCR-T細胞和CAR-T細胞的抗原識別和激活作用方式的差異
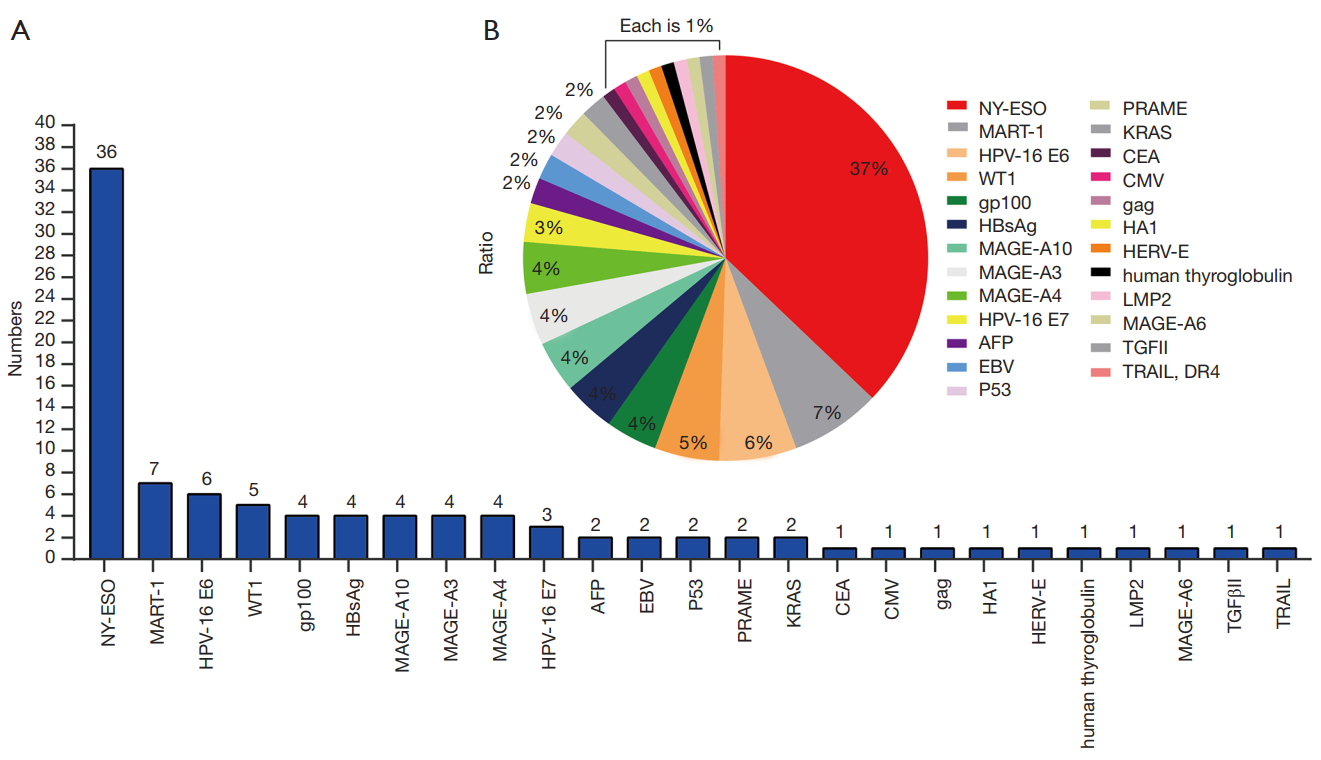
TCR-T細胞治療的靶向抗原分布情況
TCR-T的臨床研究現狀
TCR-T細胞治療的臨床試驗登記情況
黑素瘤是皮膚癌中惡性程度極高的一種腫瘤,一旦發生轉移,即對術后輔助放化療不敏感,預后極差。
2006年,首次對轉移性黑色素瘤患者使用基因工程淋巴細胞表達黑色素細胞分化抗原特異性TCR (MART-1)的淋巴細胞治療,臨床反應率很低 (2/17) [5]。隨后的一項識別MART-1抗原的TCR-T治療的研究中,20例轉移性黑色素瘤患者中有6例 (30%) 腫瘤消退 [6]。
此外,一項使用識別NY-ESO-1抗原的改良高親和TCR的研究顯示,6例滑膜細胞肉瘤患者中有4例 (60%) 有客觀臨床反應,11例黑色素瘤患者中有5例 (45%) 有客觀臨床反應 [7]。
滑膜細胞肉瘤是軟組織腫瘤中極其罕見的惡性腫瘤,目前主要以手術治療為主,具有局部侵襲性和轉移率均高的特點,發生轉移后患者預后較差。
ROBBINS等[8]將NY-ESO-1特異性的TCR基因轉導入T細胞,用于治療滑膜細胞肉瘤患者;Ⅰ期臨床試驗結果顯示,病情PR率為66.7%(4/6),其中1例患者的PR時間持續18個月。4年后,ROBBINS等[9]再次將針對NY-ESO-1的TCR-T細胞用于治療滑膜細胞肉瘤患者,Ⅱ期臨床試驗結果顯示病情反應率為61%(11/18);其中,10例患者達到PR,1例患者達到CR且時間超過20個月;隨訪發現3年和5年生存率分別為38%和14%。
此外,一項12例轉移性滑膜肉瘤患者自體輸注識別NY-ESO-1抗原的TCR-T細胞臨床試驗,50%的患者 (6/12) 出現了經證實的抗腫瘤反應,腫瘤在幾個月內有不同程度的縮小[10]。
在其他腫瘤如肝癌、肺癌、間皮瘤、尿路上皮癌、食管癌、多發性骨髓瘤等腫瘤治療中,TCR-T細胞免疫治療也正在用于臨床研究。
KAGEYAMA等[11]將MAGE-A4作為靶抗原的TCR基因轉導入T細胞,用于治療10例食管癌患者,其中3例患者存活時間超過27個月,7例患者在治療2個月內發生疾病進展。
一項采用識別NY-ESO-1/ LAGE-1抗原的TCR-T治療20例多發性骨髓瘤患者,20例晚期患者中有16例 (80%) 觀察到臨床反應,中位無進展生存期為19.1個月[12]。
展望
到目前為止,TCR-T細胞免疫療法已在部分實體腫瘤的治療中取得了較好的療效,特別是對黑素瘤、滑膜細胞肉瘤的治療效果很明顯。TCR-T細胞免疫療法作為當前過繼性T細胞治療中最新的技術之一,能夠通過表達特異性受體T細胞而靶向識別特異性的腫瘤細胞。
隨著相關技術的發展和研究的不斷深入,TCR-T細胞免疫療法將逐漸向高效、低毒及可操控的通用型方向發展,從而在腫瘤治療中具有更加理想的應用前景。
參考文獻:
[1] Jianxiang Zhang, Lingyu Wang. The Emerging World of TCR-T Cell Trials Against Cancer: A Systematic Review. doi: 10.1177/1533033819831068.
[2] Andrew D. Fesnak, Carl H. June and Bruce L. Levine. Engineered T cells: the promise and challenges of cancer immunotherapy. doi:10.1038/nrc.2016.97.
[3] Vania Lo Presti, Frank Buitenwerf, Niek P. van Til, et al. Gene Augmentation and Editing to Improve TCR Engineered T Cell Therapy against Solid Tumors.[J]. Vaccines 2020, 8, 733.
[4] Liu Q , Cai W , Zhang W , et al. Cancer immunotherapy using T-cell receptor engineered T cell[J]. Ann Blood 2020;5:5.
[5] Morgan, R. A., Dudley, M. E., Wunderlich, J. R. et al. 2006 Cancer regression in patients after transfer of genetically engineered lymphocytes[J]. Science 314:126-129.
[6] Johnson L A , Morgan R A , Dudley M E , et al. Gene therapy with human and mouse T-cell receptors mediates cancer regression and targets normal tissues expressing cognate antigen[J]. Blood, 2009, 114(3):535-546.
[7] Robbins P. F., Morgan R. A., Feldman S. A. et al. 2011 Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1. J. Clin. Oncol. 29:917-924.
[8] ROBBINS PF, MORGAN RA, FELDMAN SA, et al. Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1[J]. J Clin Oncol, 2011, 29(7): 917-924.
[9] ROBBINS PF, KASSIM SH, TRAN TL, et al. A pilot trial using lymphocytes genetically engineered with an NYESO-1-reactive T-cell receptor:longterm follow-up and correlates with response[J]. Clin Cancer Res, 2015, 21(5): 1019-1027.
[10] D'Angelo S P , Luca M , Merchant M S , et al. Antitumor Activity Associated with Prolonged Persistence of Adoptively Transferred NY-ESO-1c259T Cells in Synovial Sarcoma[J]. Cancer Discovery, 2018:CD-17-1417.
[11] KAGEYAMA S, IKEDA H, MIYAHARA Y, et al. Adoptive transfer of MAGE-A4 T-cell receptor gene-transduced lymphocytes in patients with recurrent esophageal cancer[J]. Clin Cancer Res, 2015, 21(10): 2268-2277.
[12] Rapoport A P , EA Stadtmauer, Binder-Scholl G K , et al. NY-ESO-1–specific TCR–engineered T cells mediate sustained antigen-specific antitumor effects in myeloma[J]. Nat Med. 2015 August ; 21(8): 914–921.
-END-
關于我們:
鄭州深藍海生物醫藥是北京新領先在臨床CRO領域打造的一個知名品牌。公司擁有300余人高專業水準的臨床服務團隊,并在石家莊、武漢、長沙、杭州、鄭州、沈陽、貴州、大連、廣州、西安等20多個中心城市設立駐地辦事處。
公司下設醫學部、臨床運營部、數據部、質量控制委員會、藥物警戒部、注冊部和人類遺傳資源管理委員會等部門。能夠通過創新的服務模式和多維的信息化技術,推動臨床研究的發展及臨床研究外包服務模式的變革,為客戶提供多元化的研發支持和服務,包括創新藥和仿制藥的Ⅰ~Ⅳ期臨床試驗、仿制藥生物等效性(BE)試驗及藥代動力學(PK/PD)臨床研究、體內外相關性研究(IVIVR)、醫療器械臨床研究及第三方稽查等,全面覆蓋大小分子藥物,滿足不同類型企業的臨床研究需求,為國內外客戶打通新藥上市前最關鍵的瓶頸。
目前,公司已經與國內近1000家藥物臨床機構、600余家臨床醫院建立合作,如北京大學第一醫院、北京安貞醫院、北京阜外心血管醫院、上海長海醫院、復旦大學附屬中山醫院、江蘇省人民醫院、吉林大學中日聯誼醫院、哈爾濱醫科大學附屬第一醫院、廣東中醫院、天津中醫藥大學附屬第一醫院等,合作醫院科室1500余個。


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
