建議收藏!化學合成原料藥雜質控制策略
ICH Q7A 對于原料藥(Active Pharmaceutical Ingredient, API)的定義:
任何旨在供生產一種藥物制劑,并作為其活性成分的物質或混合物,這類物質旨在疾病的診斷、治療、緩減、處置和預防及影響人體的結構和功能等方面發揮藥理作用或其他的直接效益。
根據原料藥的合成工藝,結合藥典(包括USP, EP, ChP, JP等)收載相關雜質對其中可能存在的有機雜質進行了理論分析和檢測,確定是否訂入標準進行常規控制。可能存在的有機雜質有:

重點:有機雜質研究范圍需要包括所有藥典(包括USP, EP, ChP, JP及其他法定標準,如進口注冊標準,藥品注冊標準等)收載相關雜質,無論原料藥工藝是否產生。
-
根據原料藥的合成工藝,API分子結構,相關EMA審評報告,IF文件和化學機理分析初步確定降解雜質。
-
采用有關物質方法驗證專屬性-強制降解驗,高溫(高于加速10°C),高濕(RH92.5%),酸(0.1~1.0M)、堿(0.1~1.0M)、氧化(30%H2O2)、光照保證至少有一個條件下降解5%~10%左右,確定雜質降解途徑。
穩定性期間增長,接近或大于鑒定限0.10%的降解雜質需要鑒定,并納入API質量標準,進行常規控制;大于界定限0.15%降解雜質,尚未進行毒理學試驗證明限度合理性,需要進行毒理學試驗,證明安全性;或者優化結晶工藝,改善晶型、晶癖、粒徑等因素,增強API的穩定性,不出現大于界定限0.15%的降解雜質。
開發有關物質相關方法檢測上述有機雜質,雜質控制策略如下:
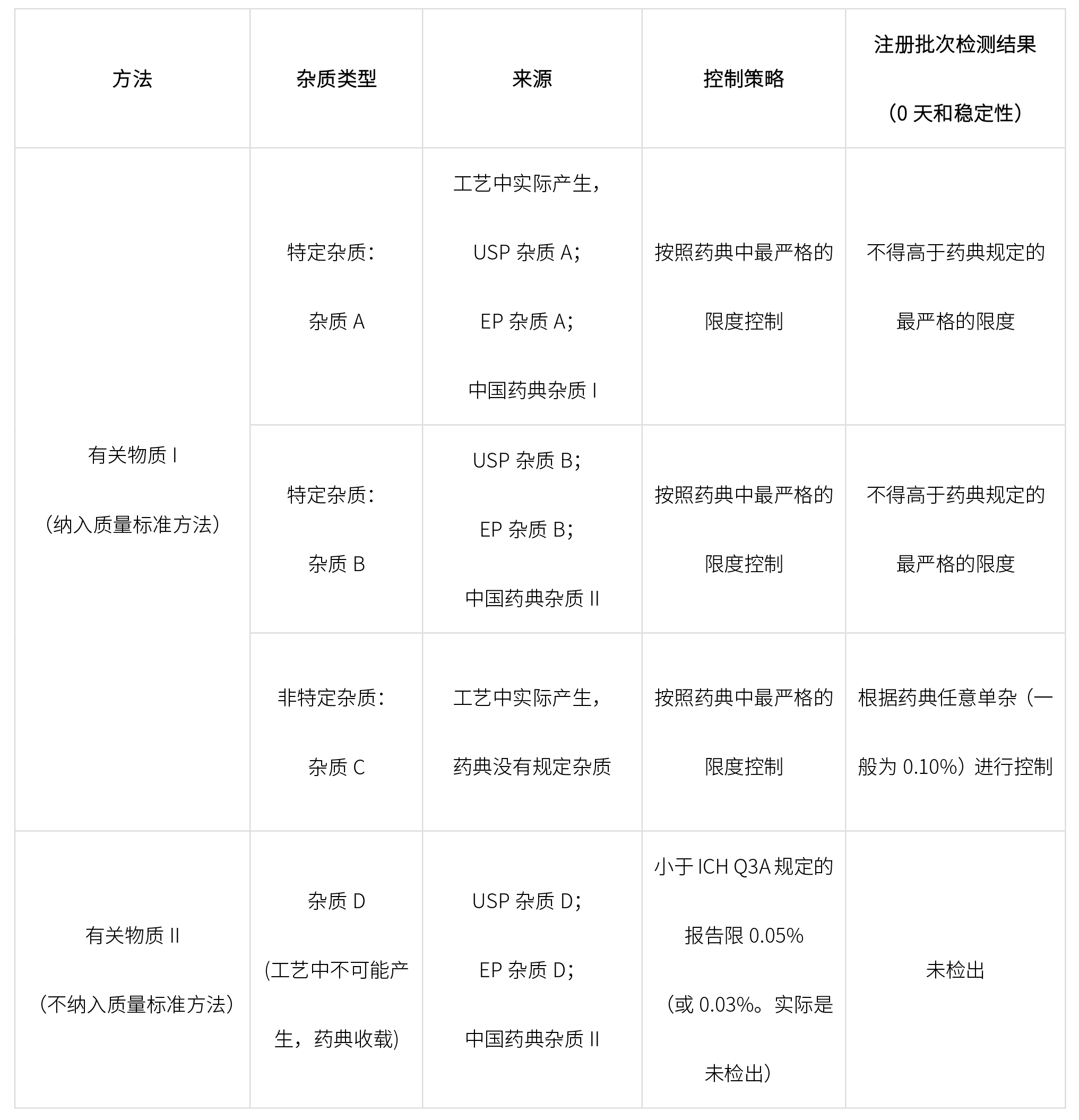
根據生產工藝和警示結構,確定產生致突變雜質,并依據ICH M7進行如下分類,確定相應的控制限度。

? 關注隊列(比一般致突變性還毒)
已確定的某些結構基團具有較高的致癌性,即使攝入量低于TTC水平,理論上仍會具有高致癌風險,這類高效致癌性致突變致癌物,被稱為關注隊列,其中包括黃曲霉毒素類、N-亞硝基化合物、烷基-氧化偶氮基化合物。
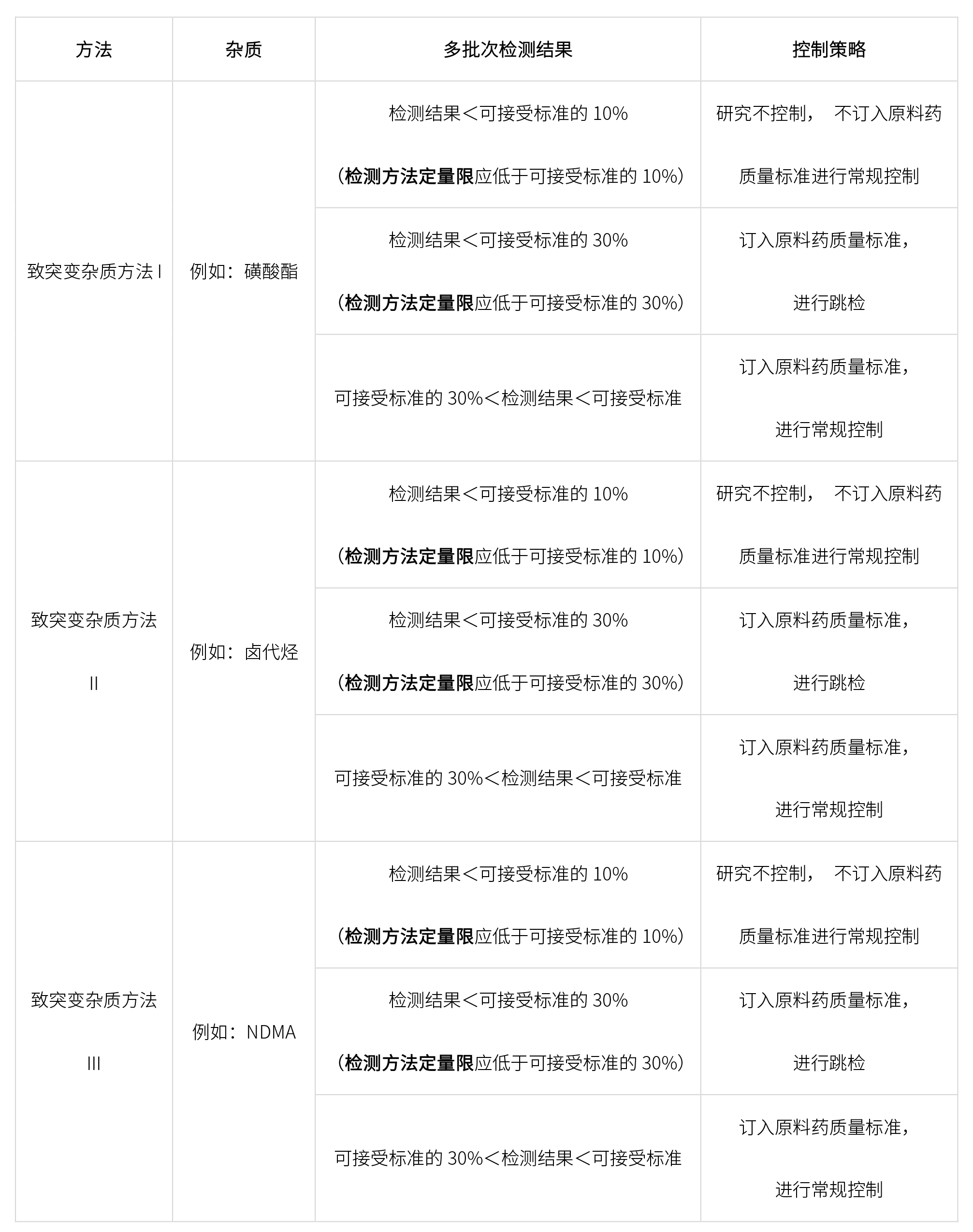
? 致突變雜質
開發致突變雜質相關方法檢測原料藥中致突變雜質,雜質控制策略如下:
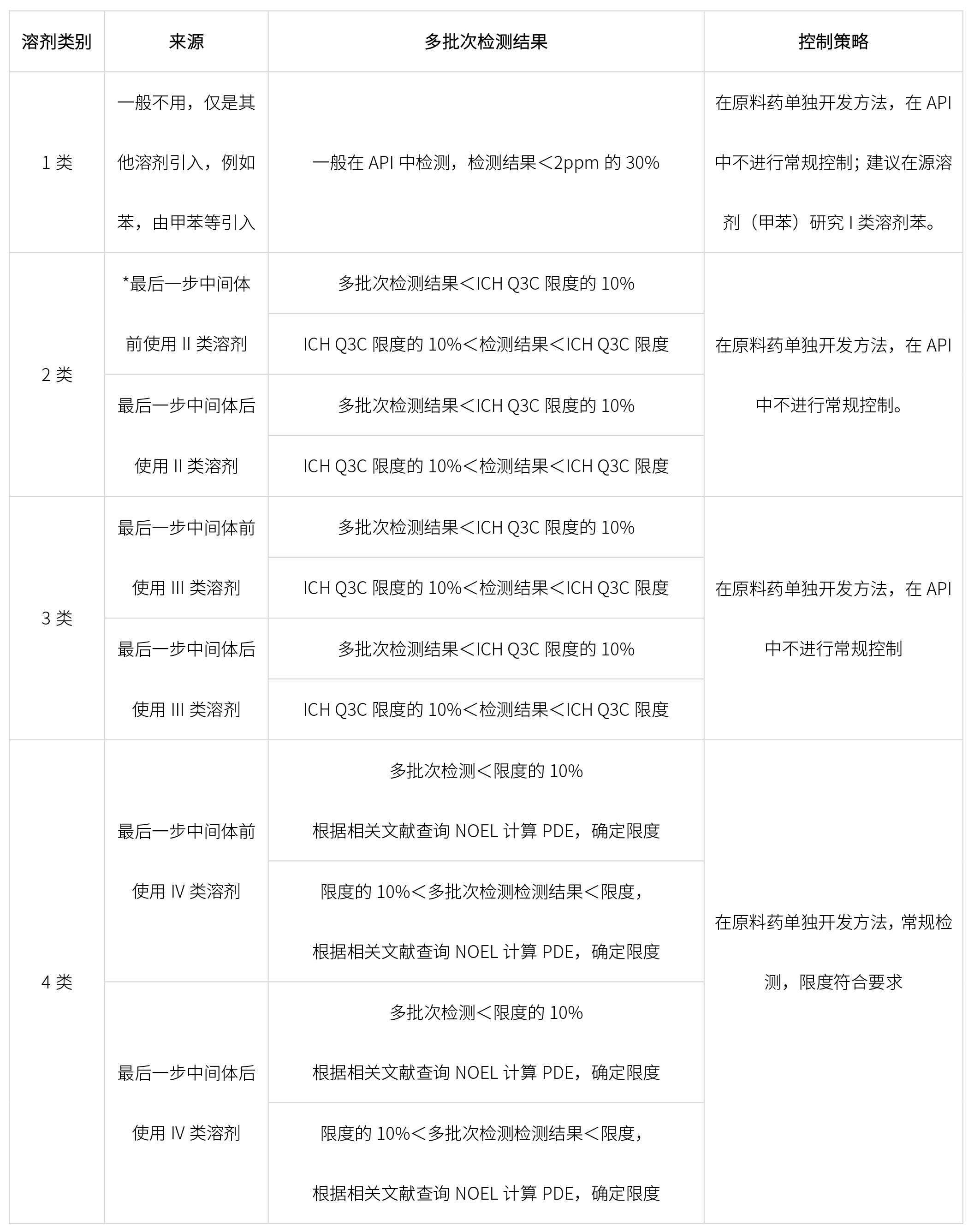
根據終產品合成工藝,結合ICH Q3C,確定控制策略如下:
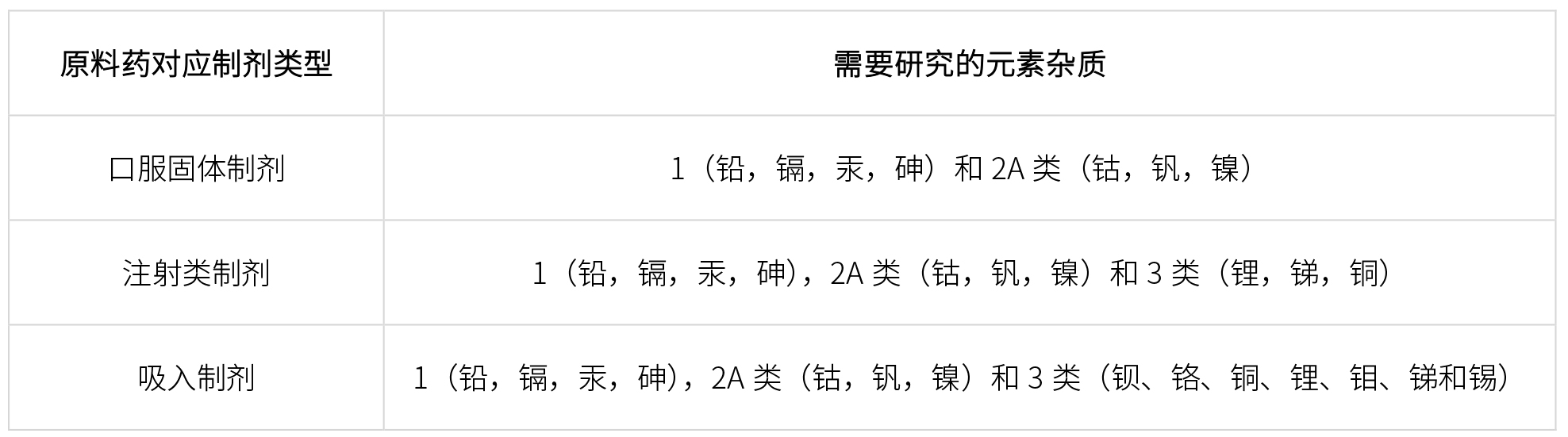
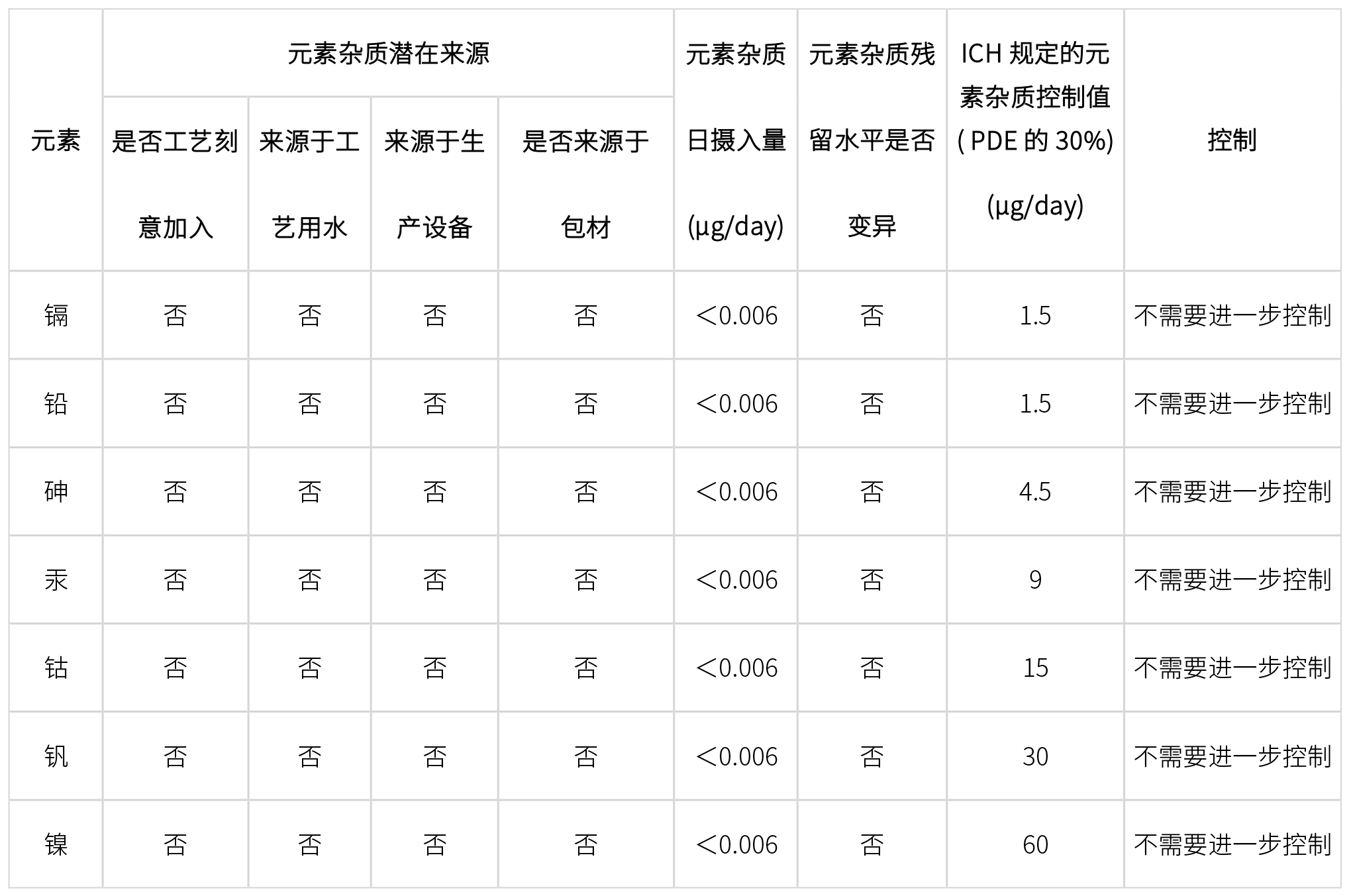
根據ICH Q3D指導原則,不同類型原料藥至少需要研究如下元素雜質:
原料藥元素雜質控制需要進行風險評估,主要從以下6個方面進行風險評估確定雜質控制策略,如下:
-
起始原料生產工藝引入
-
API生產工藝引入
-
生產設備引入
-
工藝用水引入
-
包材引入
-
元素雜質變異性評價(三批檢測數據)
經過上述一系列風險評估和相關檢測數據,確定原料藥中元素雜質最終控制策略:
? API的質量標準
根據中國藥典格式,包括性狀、鑒別、檢查和含量。
-
性狀:包括外觀,味道,溶解度,熔點,比旋度等
-
鑒別:至少有兩個專屬性鑒別,包括IR鑒別,UV鑒別,HPLC鑒別,化學鑒別
-
檢查:有關物質,異構體,殘留溶劑,水分,干燥失重,熾灼殘渣,重金屬,氯化物,硫酸鹽等(除性狀,鑒別,含量外其他所有項目)
-
含量:含量通常不小于98.5%(中國藥典沒有規定上限,默認101.0%)
API質量標準,應參照所有相關藥典,檢測項目覆蓋所有藥典,檢測限度選取藥典最嚴格的限度制定,如下:
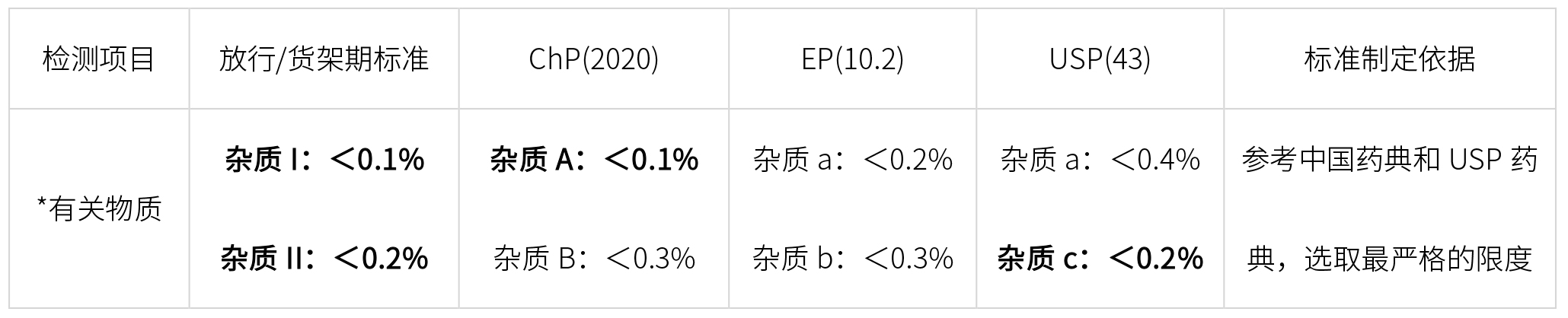
*特定雜質,藥典雜質編號可能不一樣,進行對比研究時,要一一對應。
標準原料藥的質量標準(加粗必有項目)

(*加粗字體,標準中必須包含項目,常規字體根據實際檢測結果定是否增訂入質量標準)
通過EMA審評報告或IF文件,可以了解包材和穩定性相關信息,主要對光是否敏感,對熱是否敏感,是否具有吸濕性等。
穩定性考察內容:影響因素考察(包括包材研究)
-
光,在白熾燈和UV燈照射下,總照度不低于1.2×106Lux·hr,UV不低于200w·hr/m2。放置11天,在0、5、11天取樣。若前期調研,對光敏感,需要進行多種放置條件,帶包裝和裸放,確定對光是否敏感,證明包材合理性
-
熱,高于加速溫度10°C,放置30天,在0、5、10、30 天取樣,裸放
-
濕,在25°C,90%±5%,放置30天,在0、5、10、30天取樣,裸放,若前提調研產品具有吸濕性,帶包裝和裸放,確定是否具有吸濕性,證明包材合理性
? 穩定性考察內容-加速和長期穩定性(常溫條件下)
批次要求:采用注冊批次三批;包裝:市售包裝一致
加速: 40±2°C,75%±5%;中間:30±2°C,65%±5%
長期:25±2°C,60%±5%
取樣頻率:加速:0、1、2、3、6;長期:0、3、6、9、12、18、24、36、48
監控項目:加速6個月,長期12、24、36、48個月需要進行全檢;
其他項目可根據穩定性變化項目進行考察
顯著變化:對于API來說,超出限度,就是顯著變化
? 穩定性考察內容-加速和長期穩定性(冷凍條件下)
批次要求:采用注冊批次三批;包裝:市售包裝一致
長期:-20±5°C 取樣頻率:長期:0、3、6、9、12、18、24、36、48
監控項目:長期12、24、36、48個月需要進行全檢;其他項目可根據穩定性變化項目進行考察
備注:了解短期偏離儲藏條件(運輸或搬運過程)對API影響,即采用一批原料藥,在略高溫度(5±3°C/25±2,60%±5%),放置適當時間(例如10天,20天或1個月)且取樣更頻繁的測試論證
參考文獻
ICH Q7 活性藥物成分(API)的GMP指南
ICH Q3A 新原料藥中雜質
ICH Q3C 殘留溶劑的指導原則
ICH Q3D 元素雜質指導原則
EMA殘留溶劑指南
EMA關于沙坦藥品中亞硝胺風險評估報告
80號文化學藥品新注冊分類申報資料要求
-END-
關于我們:
原料藥研究事業部現有研發人員近百人,近80%為碩士或博士學歷。由具有10年以上國內外項目管理、藥品開發、生產轉化、注冊申報經驗人員作為主要研究和管理者,形成具有集產品立項、高端中間體、工藝開發、質量全面研究、產業化轉移、中美雙報、單制劑原料藥評價于一體的原料藥全產業鏈構架。
事業部由6大中心組成,分別是工藝研發中心、產業化中心、質控中心、雜質中心、注冊中心和技術服務中心。工藝研發中心主要包含抗生素研發平臺、創新工藝研發平臺、復雜藥物分析研發平臺、結晶研發平臺和原料藥粉體學研究平臺。產業化中心主要包含起始原料、API資質控制平臺、工藝驗證、技術轉移風險控制平臺。質控中心主要包含方法學建立和驗證平臺、雜質研究技術包服務平臺。雜質中心主要包括雜質制備、MS檢測和公共對照品控制等。注冊中心注冊經驗豐富,可以承接中美雙報。技術服務中心服務于立項、市場、制劑、采購部等與原料相關的技術支持。
新領先醫藥原料藥事業部可以助力廣大業內中間體生產商實現產業升級為原料藥供應商、助力制藥企業快速確定起始原料供應商、快速完成研發、轉移、注冊申報,獲得生產批件。???


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
