政策法規||本周重磅政策法規概覽(21.03.15-21.03.19)
NMPA/CDE/藥典委公布藥品/醫療器械相關內容本周集錦。
01
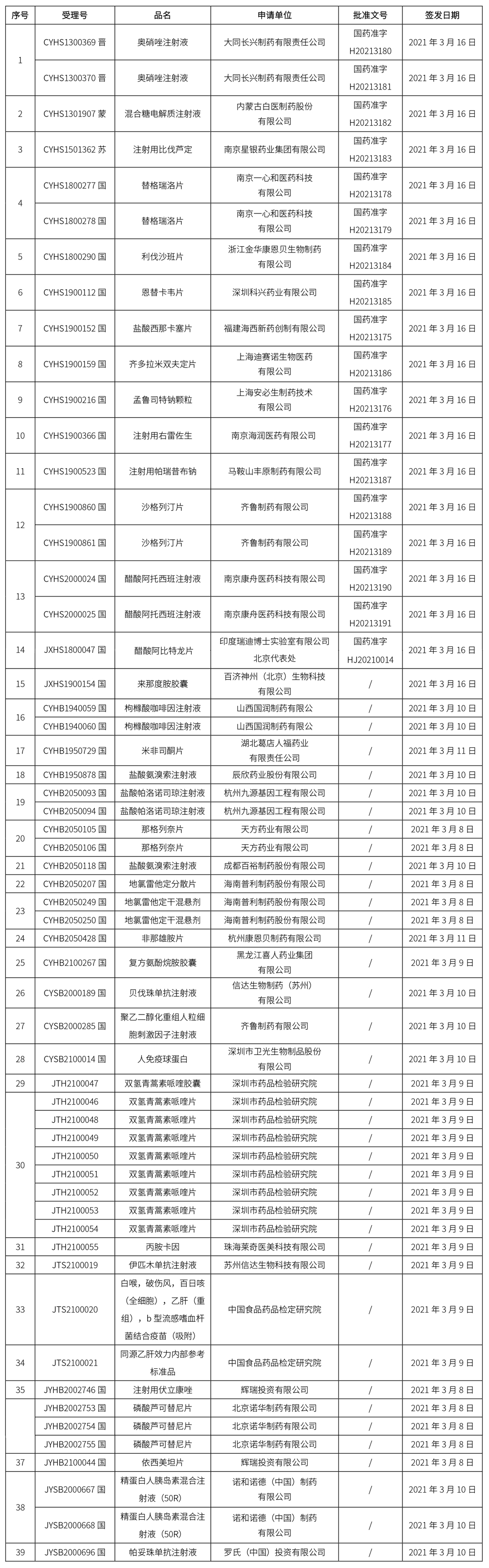
本周共發布39個品種批準證明文件待領取通知,其中一致性評價品種8個,注射劑品種16個。
關于發布《創新藥(化學藥)臨床試驗期間藥學變更技術指導原則(試行)》的通告(2021年第22號)

掃描下方二維碼
查看相關信息

關于硝酸咪康唑陰道片處方藥轉換為非處方藥的公告(2021年第34號)

掃描下方二維碼
查看相關信息

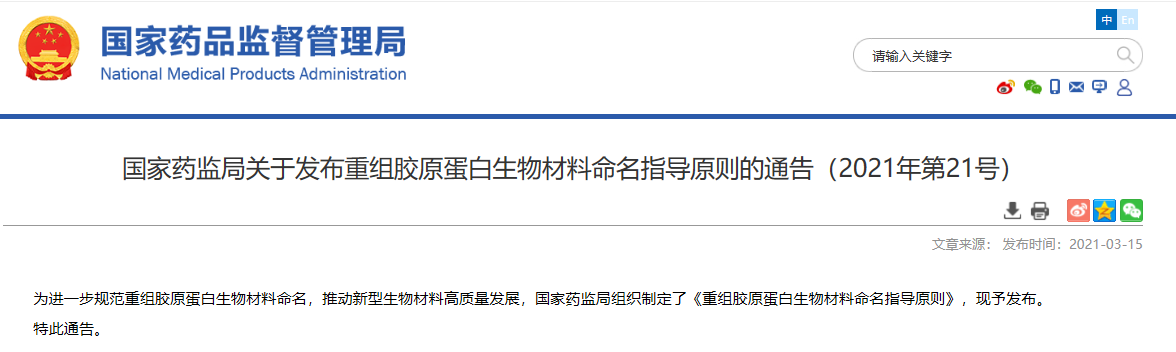
關于發布重組膠原蛋白生物材料命名指導原則的通告(2021年第21號)
掃描下方二維碼
查看相關信息

05
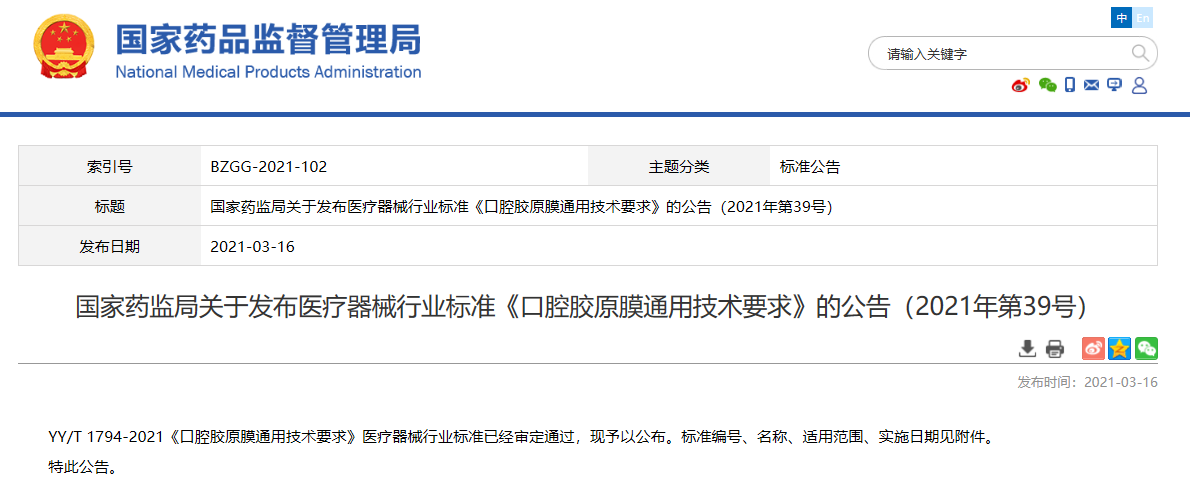
關于發布醫療器械行業標準《口腔膠原膜通用技術要求》的公告(2021年第39號)
掃描下方二維碼
查看相關信息

關于發布《皮膚外用化學仿制藥研究技術指導原則(試行)》的通告(2021年第23號)

掃描下方二維碼
查看相關信息

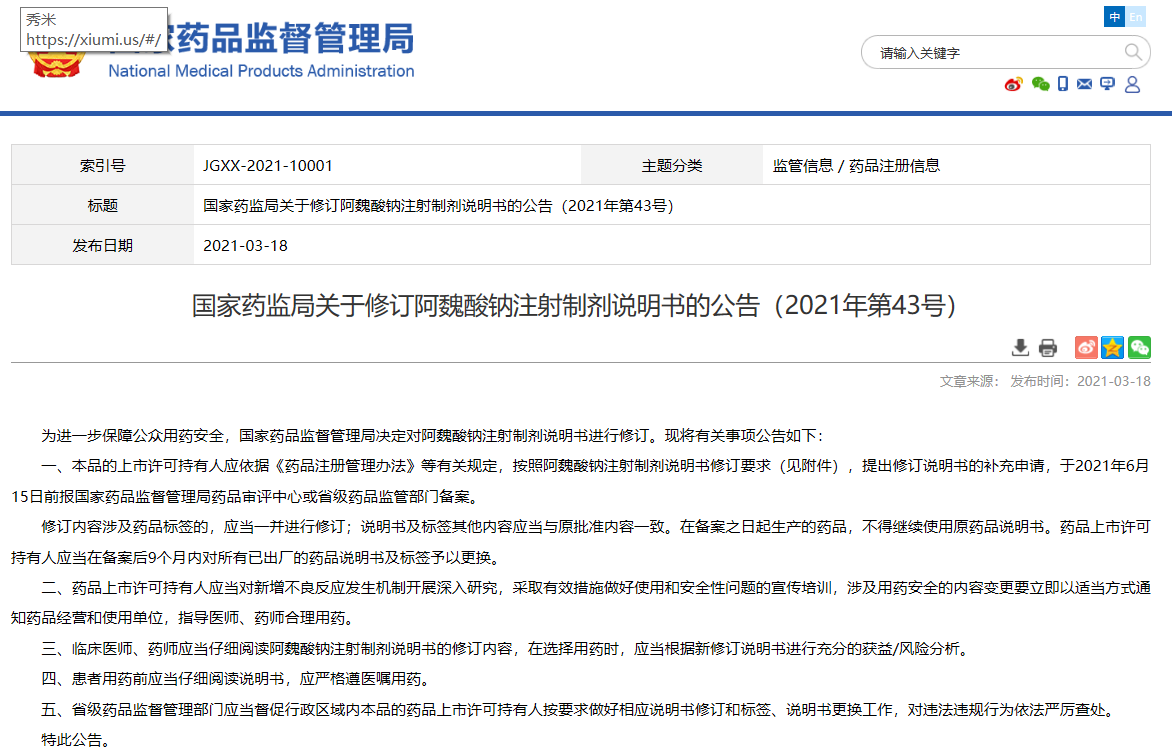
關于修訂阿魏酸鈉注射制劑說明書的公告(2021年第43號)
掃描下方二維碼
查看相關信息

關于修訂氟哌啶醇制劑說明書的公告(2021年 第40號)
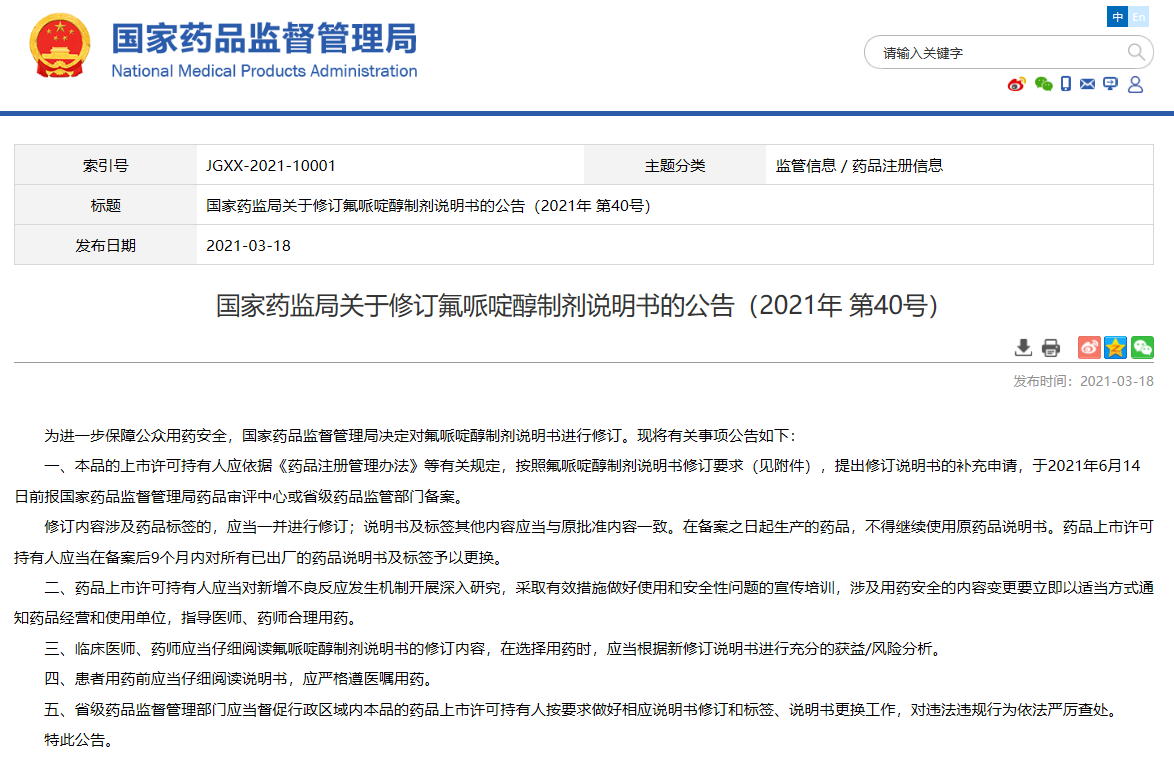
查看相關信息

關于發布《皮膚外用化學仿制藥研究技術指導原則(試行)》的通告(2021年第23號)

查看相關信息

本周發布11個品種的國家藥品標準公示。
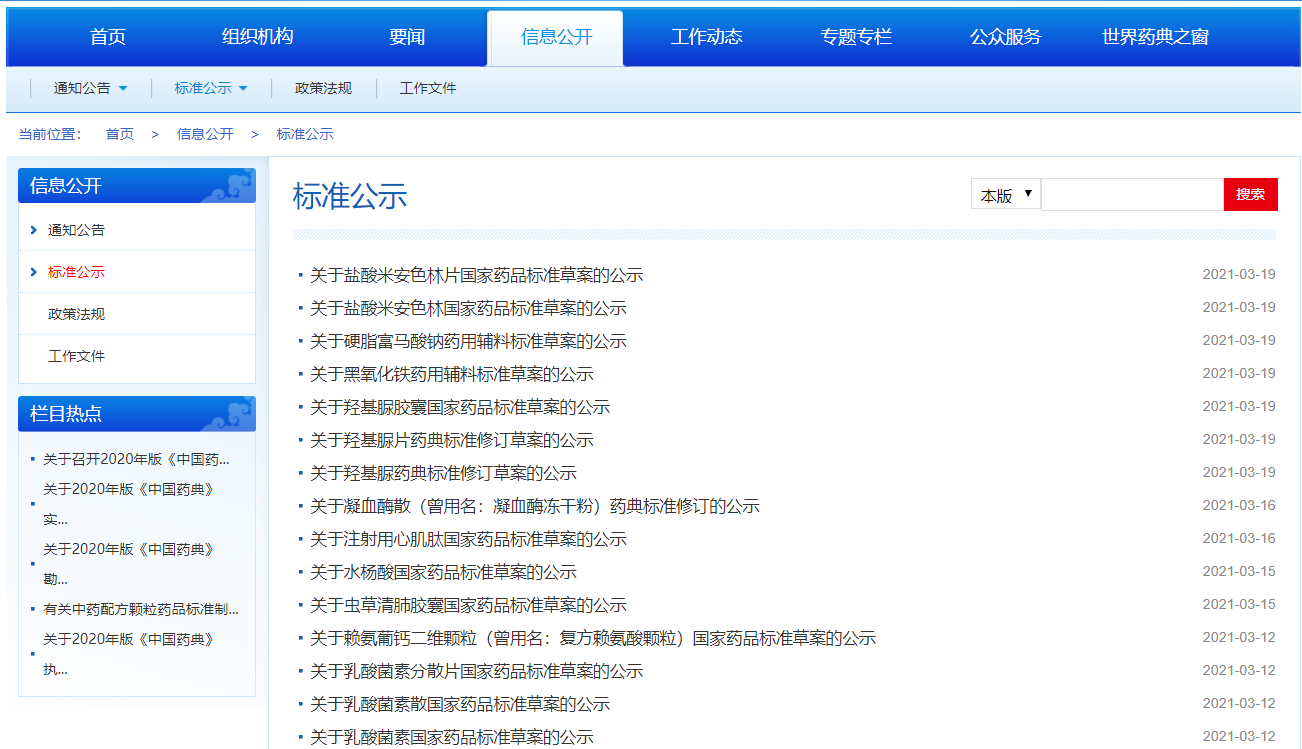
掃描下方二維碼
查看相關信息

-END-
關于我們:
藥政部是隸屬于公司副總裁直接領導下的部門,以國家藥品政策為導向,以為客戶提供集藥物研發、注冊申報、現場核查等一體化專業技術服務為宗旨,以高效、成功申報項目最終目標。
藥政部擁有一支技術與注冊經驗豐富的團隊,作為一家提供專業服務的公司,在原料藥登記、仿制藥一致性評價、仿制藥注冊、新藥注冊以及進口藥品注冊等方面均具有專業且豐富的經驗,已助力成功申報多項藥品注冊申請,在業內具有良好的口碑。
部門堅持 “忠誠、思考、建設、承擔、分享”的公司理念,不斷加強人才隊伍建設、提升專業能力、豐富注冊經驗、拓展業務范圍,致力于為客戶提供高效率、高質量、合規的技術服務,為保護和促進公眾健康而不懈努力。


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
