政策法規||本周重磅政策法規概覽(20.11.16-11.20)
NMPA
01
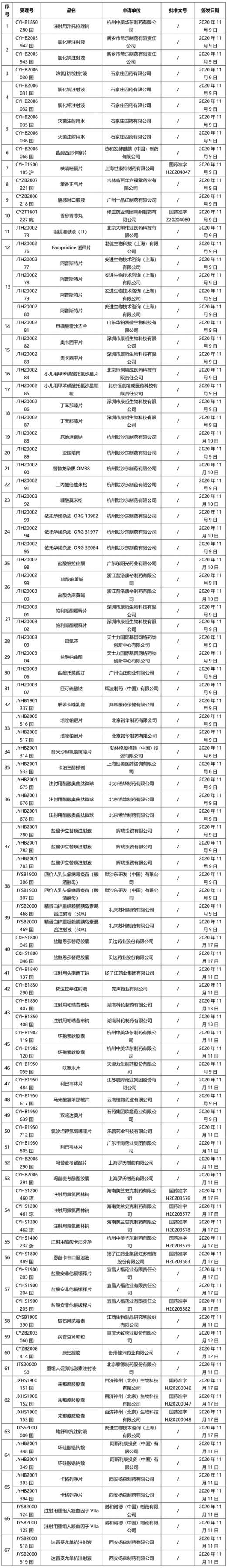
本周共計67+72個品種獲批取得藥品批準證明文件(特殊藥品批文72個),其中一致性評價品種10個,包括注射劑品種4個,且注射用頭孢西丁鈉、依達拉奉注射液為首家過評品種。
02
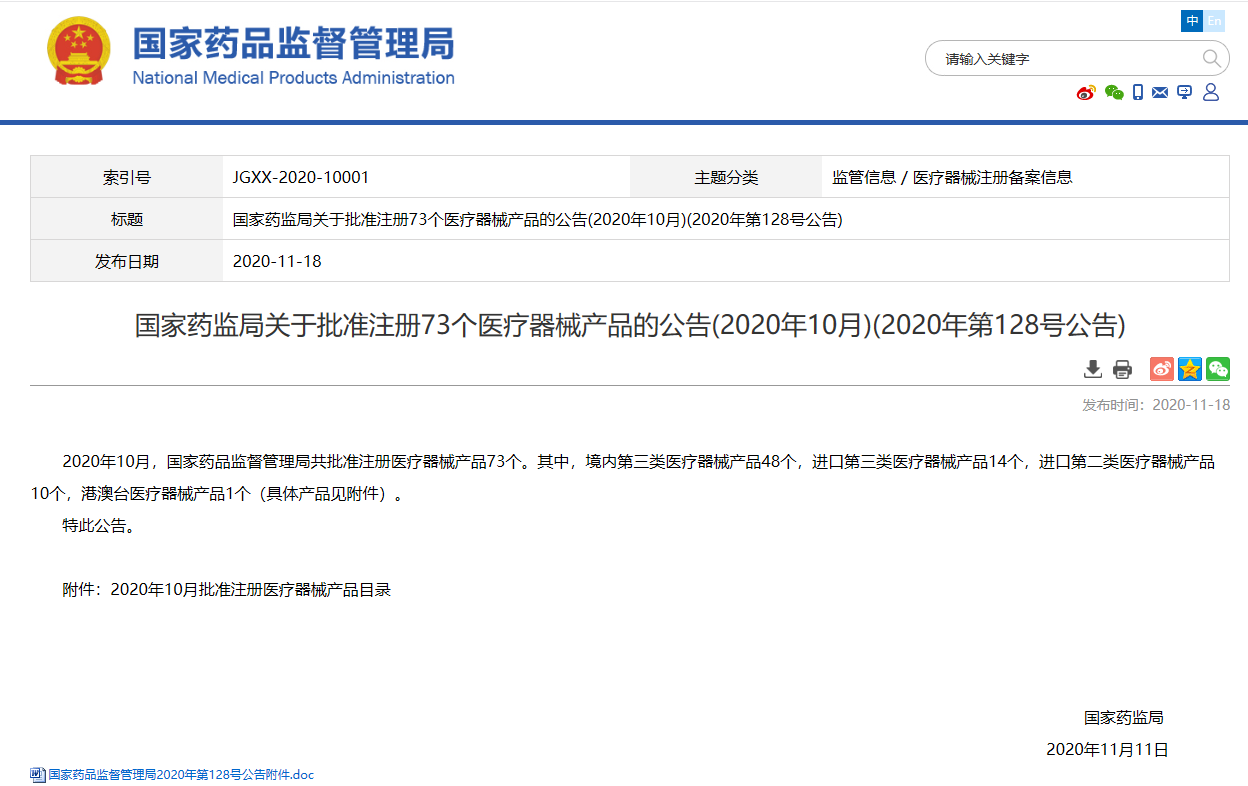
國家藥監局關于批準注冊73個醫療器械產品的公告(2020年10月)(2020年第128號公告)
雙11當天,NMPA公告批準注冊醫療器械產品73個。其中,境內第三類醫療器械產品48個,進口第三類醫療器械產品14個,進口第二類醫療器械產品10個,港澳臺醫療器械產品1個。
掃描圖中二維碼
查看詳細文件

03
國家藥監局關于發布國家醫療器械監督抽檢結果的通告(第4號)(2020年第74號)
NMPA組織對半導體激光治療機、超聲潔牙設備、手術衣等5個品種的產品進行了質量監督抽檢,共27批(臺)產品不符合標準規定。

掃描圖中二維碼
查看詳細文件

CDE
01
關于發布《化學仿制藥參比制劑目錄(第三十五批)》的公示(征求意見稿)
本批公布共計42個品規的參比制劑來源,其中新增補15個;并且9個品種未通過審議,原因主要集中于與其他已上市制劑比較無臨床應用優勢、適應癥/用法用量/規格/裝量等不滿足臨床需求、安全性及有效性數據不充分。

掃描圖中二維碼
查看詳細文件

02
關于藥審中心與中國藥品監督管理研究會合作舉辦ICH Q3D、Q6A、E4、M4指導原則培訓的通知
線上培訓,不收取報名費,時間:2020年11月28日上午9:00-12:10。

掃描圖中二維碼
查看詳細文件

03
關于發布《藥品附條件批準上市技術指導原則(試行)》的通告(2020年第41號)
適用以下情形的藥品:
①.治療嚴重危及生命且尚無有效治療手段的疾病以及公共衛生方面急需的藥品,藥物臨床試驗已有數據顯示療效并能預測其臨床價值的;
②.應對重大突發公共衛生事件急需的疫苗或者國家衛生健康委員會認定急需的其他疫苗,經評估獲益大于風險的。

掃描圖中二維碼
查看詳細文件

04
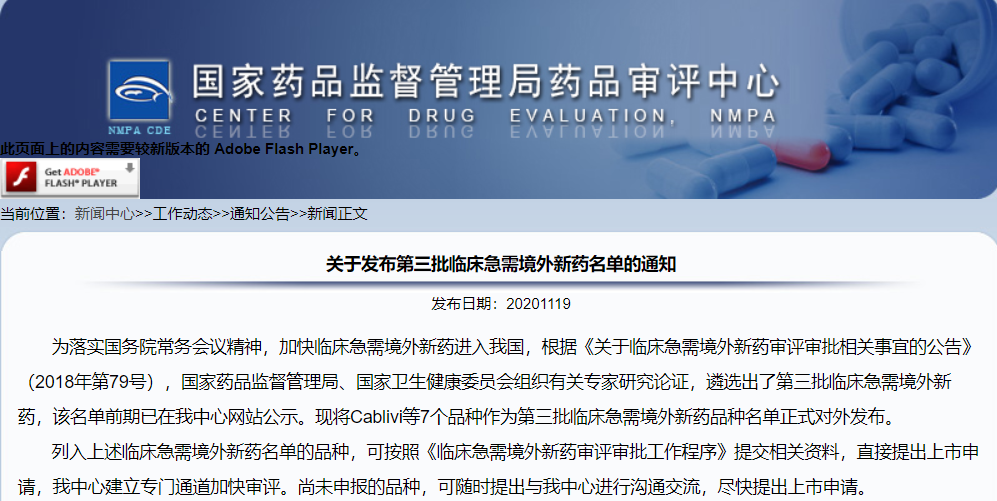
第三批臨床急需境外新藥名單發布
截止當前,CDE共發布三批臨床急需境外新藥目錄,以加快臨床急需的境外上市新藥進入我國,共計罕見病用藥、臨床優勢明顯、新的有效治療藥物選擇73個品種。
掃描圖中二維碼
查看詳細文件

CFDI
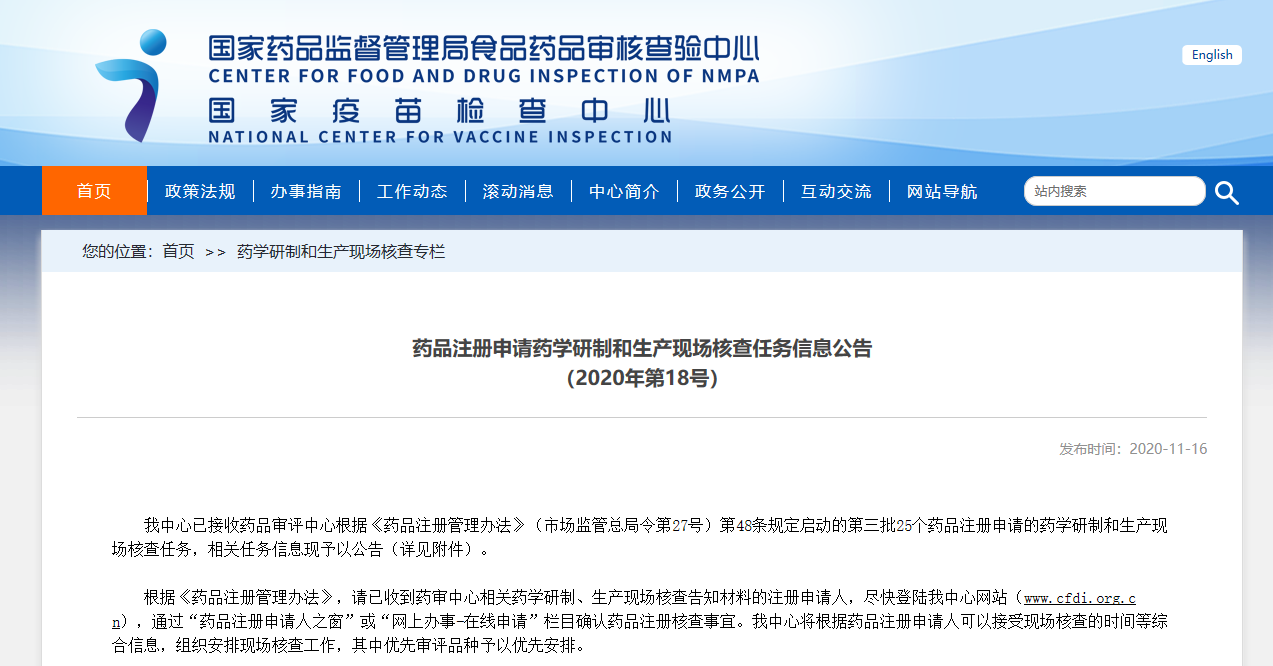
藥品注冊申請藥學研制和生產現場檢查任務信息公告
CFDI先后發布2批次,共計74個品種檢查公告。
PS:基于風險的注冊核查,風險的評估包括品種風險與研發生產主體合規性風險,會綜合考慮兩方面來評判。
掃描圖中二維碼
查看詳細文件

掃描圖中二維碼
查看詳細文件

藥典委
本周人參固本口服液、石吊蘭片、生化丸、鮭降鈣素鼻噴霧劑國家藥品標準公示。

掃描圖中二維碼
查看詳細文件

-END-
關于我們:
藥政部是隸屬于公司副總裁直接領導下的部門,以國家藥品政策為導向,以為客戶提供集藥物研發、注冊申報、現場核查等一體化專業技術服務為宗旨,以高效、成功申報項目最終目標。
藥政部擁有一支技術與注冊經驗豐富的團隊,作為一家提供專業服務的公司,在原料藥登記、仿制藥一致性評價、仿制藥注冊、新藥注冊以及進口藥品注冊等方面均具有專業且豐富的經驗,已助力成功申報多項藥品注冊申請,在業內具有良好的口碑。
部門堅持 “忠誠、思考、建設、承擔、分享”的公司理念,不斷加強人才隊伍建設、提升專業能力、豐富注冊經驗、拓展業務范圍,致力于為客戶提供高效率、高質量、合規的技術服務,為保護和促進公眾健康而不懈努力。


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
