政策法規||假期作業如期而至,本周重磅法規概覽(20.12.28-12.31)
CDE
01
關于發布《化學藥品注射劑滅菌和無菌工藝研究及驗證指導原則(試行)》的通告(2020年第53號)

02
關于發布《治療脂代謝紊亂藥物臨床試驗技術指導原則》的通告(2020年第68號)

03
關于發布《單純性尿路感染抗菌藥物臨床試驗技術指導原則》等5個指導原則的通告(2020年第69號)

04
關于發布《兒科用藥臨床藥理學研究技術指導原則》的通告(2020年第70號)

05
關于發布《兒童用藥(化學藥品)藥學開發指導原則(試行)》的通告(2020年第67號)

06
關于發布《抗腫瘤創新藥上市申請安全性總結資料準備技術指導原則》的通告(2020年第56號)

07
關于發布《化學藥品改良型新藥臨床試驗技術指導原則》的通告(2020年第54號)

08
關于發布《藥物臨床試驗多重性問題指導原則(試行)》的通告(2020年第66號)

09
關于發布《藥物臨床試驗協變量校正指導原則》的通告(2020年第65號)

10
關于發布《藥物臨床試驗亞組分析指導原則(試行)》的通告(2020年第64號)

11
關于發布《群體藥代動力學研究技術指導原則》的通告(2020年第63號)

12
關于發布《窄治療指數藥物生物等效性研究技術指導原則》的通告(2020年第62號)
13
關于發布《抗腫瘤藥物臨床試驗統計學設計指導原則(試行)》的通告(2020年第61號)

14

15
關于發布《模型引導的藥物研發技術指導原則》的通告(2020年第59號)

16
關于發布《抗腫瘤藥聯合治療臨床試驗技術指導原則》的通告(2020年第55號)

17
關于發布《中藥新藥用于慢性便秘臨床研究技術指導原則》《中藥新藥用于糖尿病腎臟疾病臨床研究技術指導原則》的通告(2020年第57號)

18
關于開通使用國家藥監局網上辦事大廳統一登錄入口的通知

19
關于發布《藥品審評審批信息公開管理辦法》的通告(2020年第58號)

NMPA
01
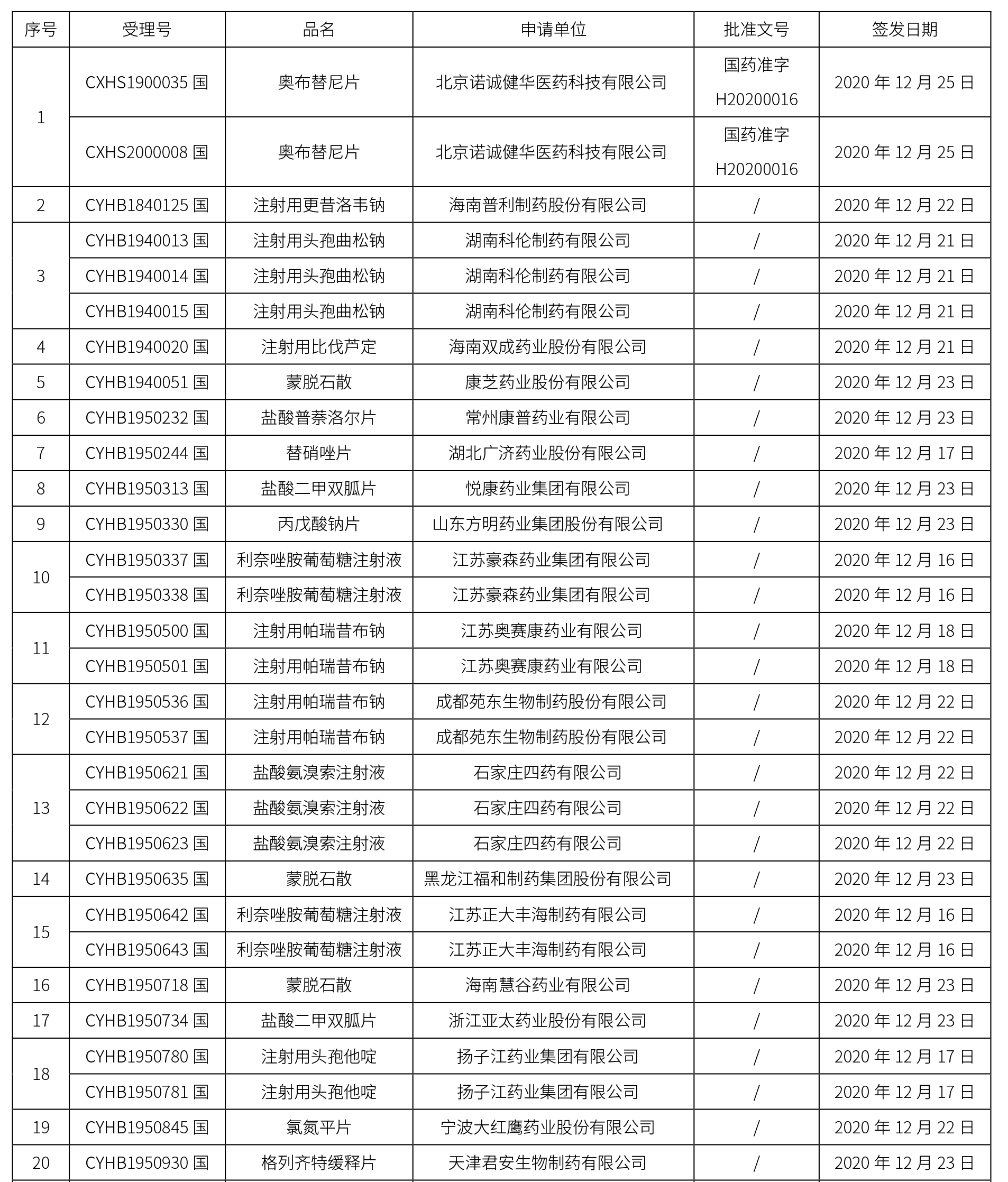
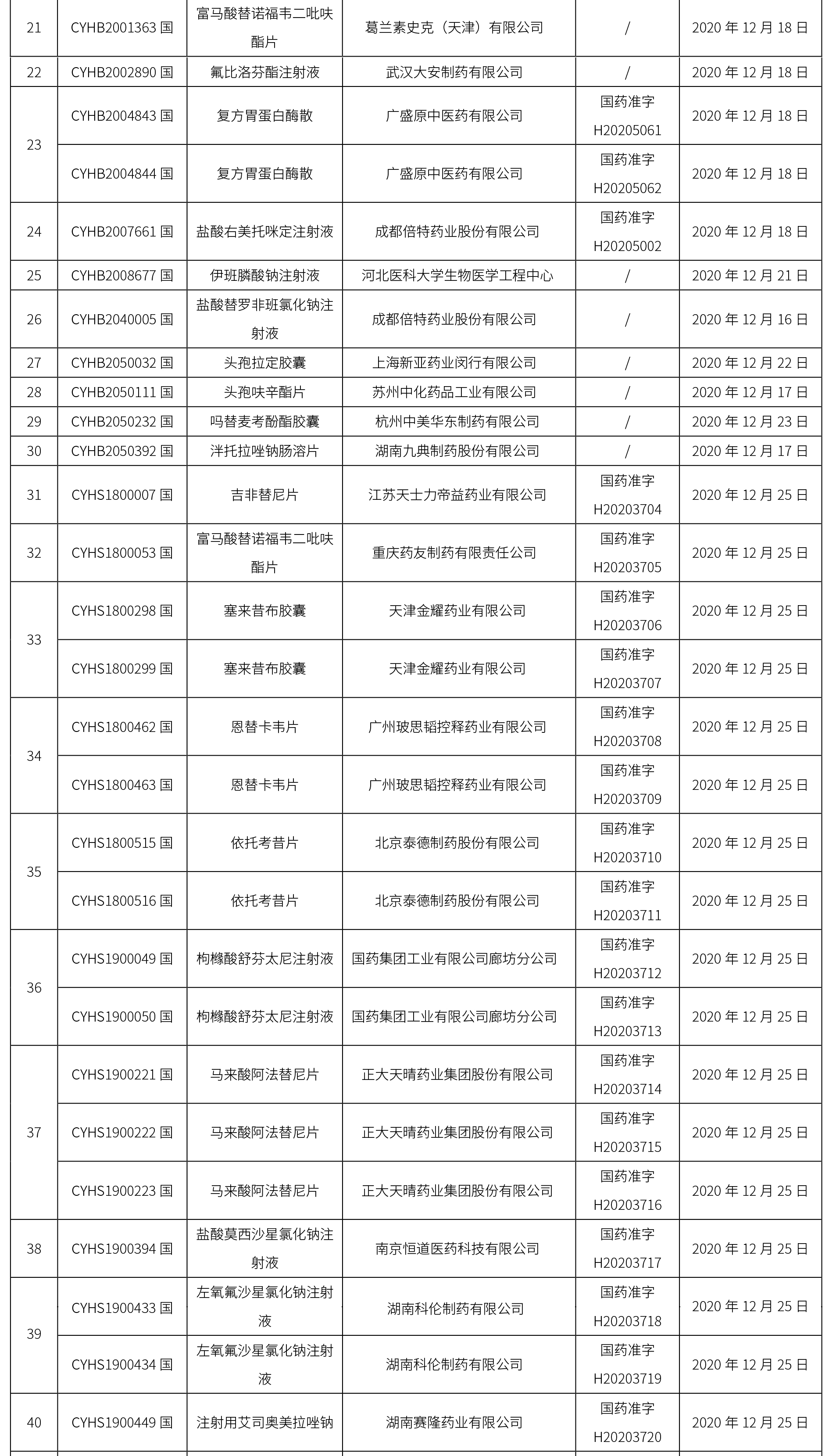
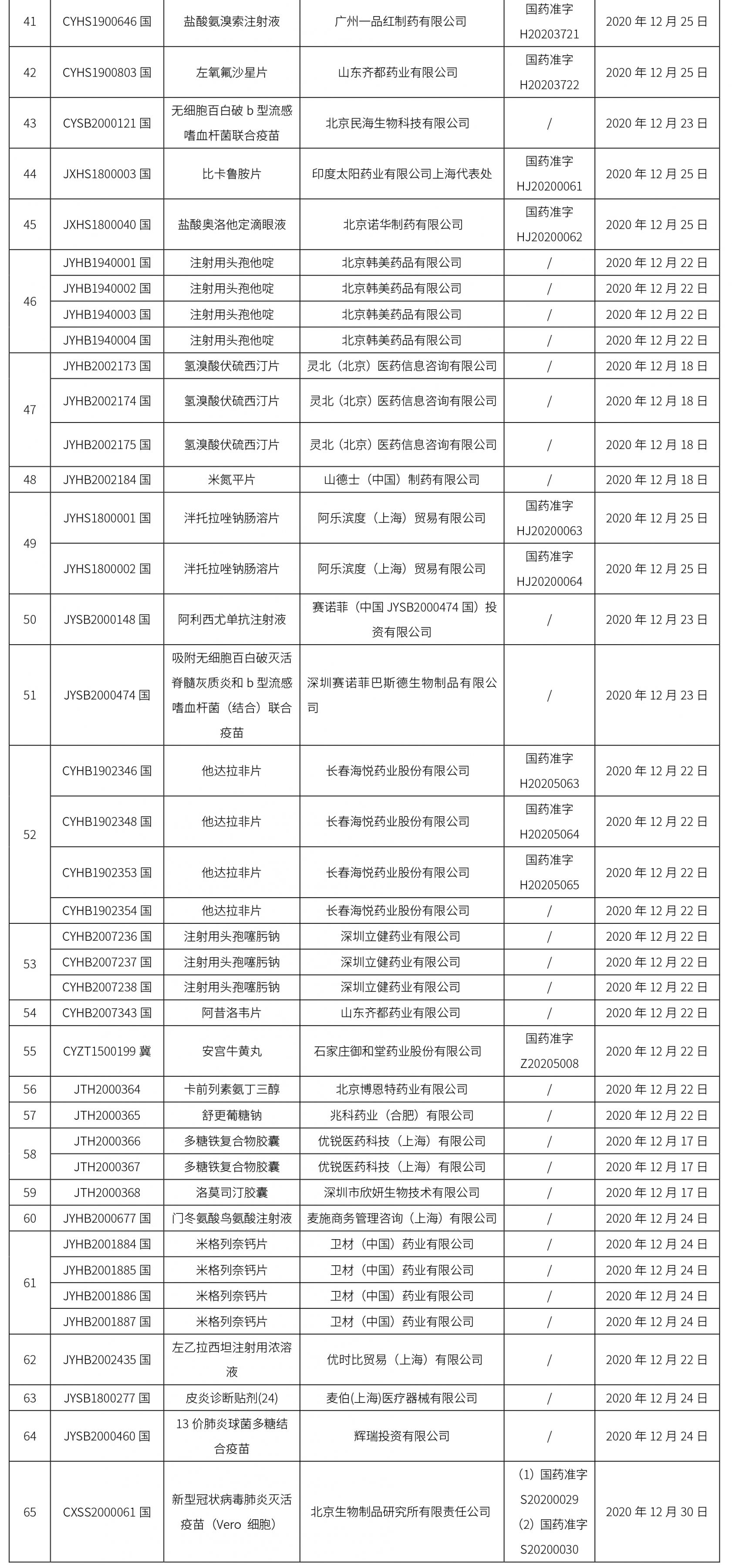
本周共計65個品種獲批取得藥品批準證明文件,其中一致性評價品種20個,包括注射劑品種7個,其中注射用更昔洛韋鈉為首家過評品種。
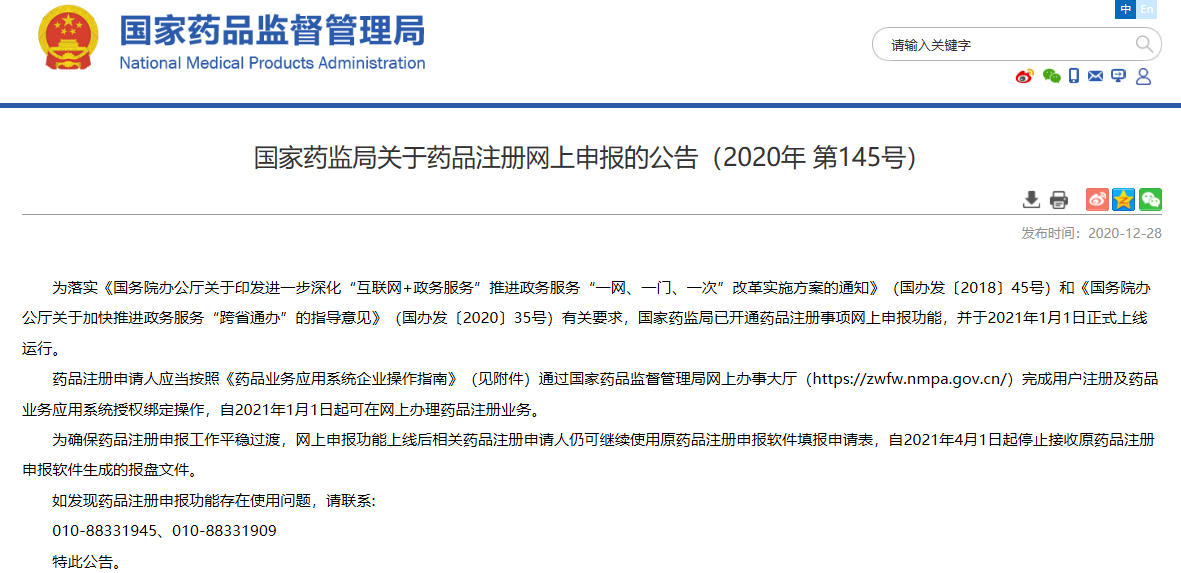
02
關于藥品注冊網上申報的公告(2020年 第145號)
為落實《國務院辦公廳關于印發進一步深化“互聯網+政務服務”推進政務服務“一網、一門、一次”改革實施方案的通知》(國辦發〔2018〕45號)和《國務院辦公廳關于加快推進政務服務“跨省通辦”的指導意見》(國辦發〔2020〕35號)有關要求,國家藥監局已開通藥品注冊事項網上申報功能,并于2021年1月1日正式上線運行。
掃描下方二維碼
查看具體法規內容

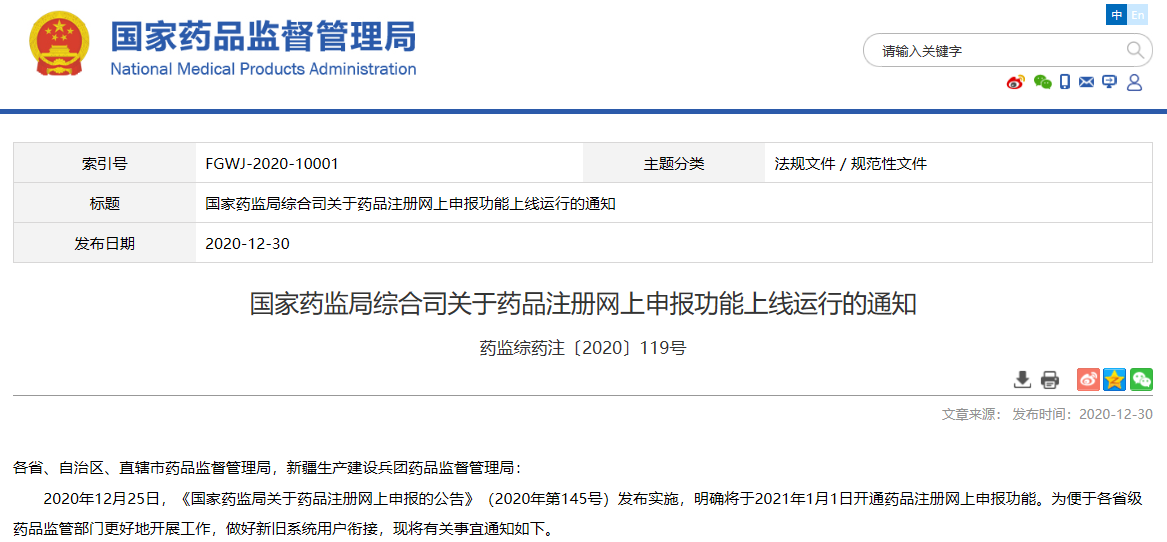
03
關于藥品注冊網上申報功能上線運行的通知
掃描下方二維碼
查看具體法規內容

04
關于注銷諾氟沙星膠囊等207個藥品注冊證書的公告(2020年第142號)

查看具體法規內容

05
關于發布仿制藥參比制劑目錄(第三十五批)的通告(2020年第92號)

掃描下方二維碼
查看具體法規內容

06
關于發布國家醫療器械監督抽檢結果的通告(第5號)(2020年 第91號)
國家藥品監督管理局組織對定制式固定義齒、醫用氧氣濃縮器(醫用制氧機)、特定電磁波治療器等11個品種進行了產品質量監督抽檢,共52批(臺)產品不符合標準規定。

掃描下方二維碼
查看具體法規內容

CFDI
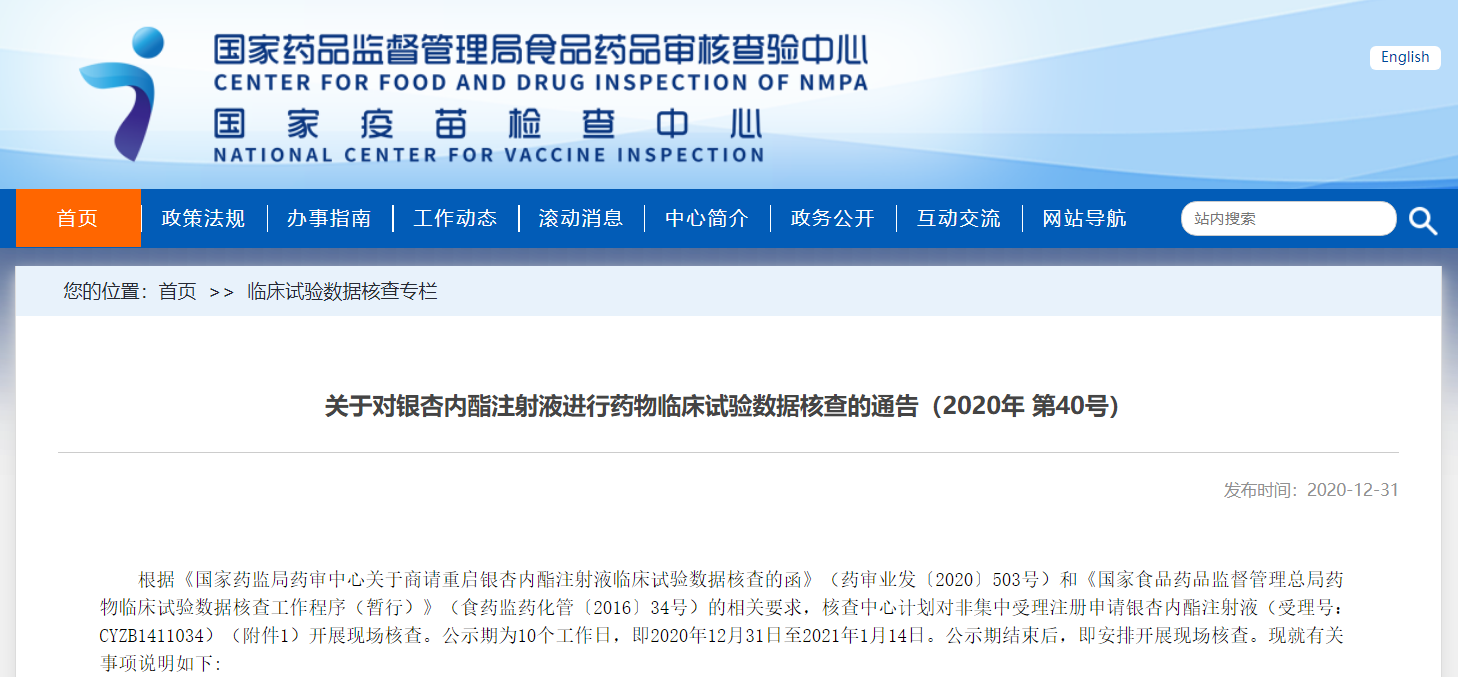
關于對銀杏內酯注射液進行藥物臨床試驗數據核查的通告(2020年 第40號)
掃描下方二維碼
查看具體法規內容

藥典委
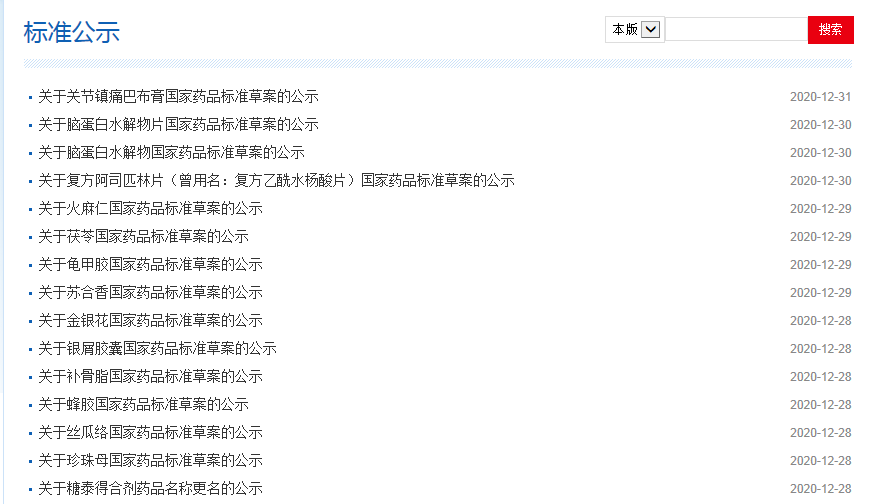
本周健脾止瀉寧顆粒、銀屑膠囊、火麻仁、關節鎮痛巴布膏等國家藥品標準公示如下:
掃描下方二維碼
查看具體法規內容

-END-
關于我們:
藥政部是隸屬于公司副總裁直接領導下的部門,以國家藥品政策為導向,以為客戶提供集藥物研發、注冊申報、現場核查等一體化專業技術服務為宗旨,以高效、成功申報項目最終目標。
藥政部擁有一支技術與注冊經驗豐富的團隊,作為一家提供專業服務的公司,在原料藥登記、仿制藥一致性評價、仿制藥注冊、新藥注冊以及進口藥品注冊等方面均具有專業且豐富的經驗,已助力成功申報多項藥品注冊申請,在業內具有良好的口碑。
部門堅持 “忠誠、思考、建設、承擔、分享”的公司理念,不斷加強人才隊伍建設、提升專業能力、豐富注冊經驗、拓展業務范圍,致力于為客戶提供高效率、高質量、合規的技術服務,為保護和促進公眾健康而不懈努力。


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
