建議收藏!原料藥合成中起始原料雜質控制策略!
起始原料(Starting material)是構成API 結構的重要結構組成部分的一種原料、中間體或API。它可以是已上市的商品、以合同或商業協議方式購自一家或多家供應商的產品,或是企業自己生產的物質。根據國內外GMP要求,起始原料作為GMP監控的起點,需要接受國內外官方機構的監督檢查。
依據ICH Q11起始原料選擇依據,起始原料的選擇依據以下幾條:
1)原料A和B為原料藥API構成具有療效的關鍵結構片段。
2)原料A和B/中間體C/D質量標準均已建立,相關雜質(有機雜質,致突變雜質,殘留溶劑和元素雜質)控制,確保上述雜質經過后續生產工藝可以有效去除,殘留符合相關ICH指導原則限度。
3)原料藥API中相關藥典規定的雜質在制備中間體C和中間體D中產生并且進行控制,確保生產的原料藥符合內控標準要求。
4)原料藥申報路線與原研廠家路線一致,或甚至更長(若適用)。
5)對于外購物料A和B,進行供應商審計和資質確認,簽訂質量協議,要求對原料質量可能產生影響的任何變更及時通知藥品企業。
我們根據供應商提供的起始原料的合成工藝,對其中可能存在的有機雜質進行了理論分析。可能存在的有機雜質有:

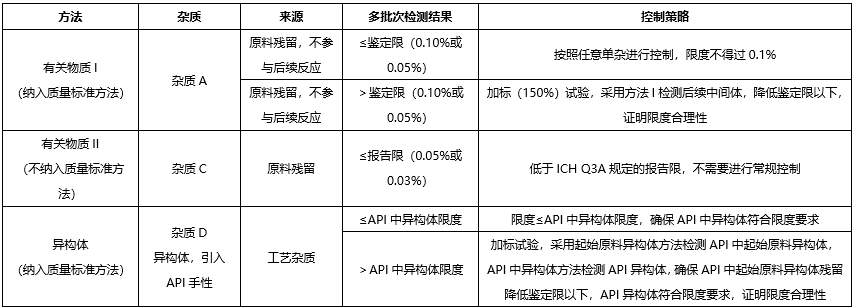
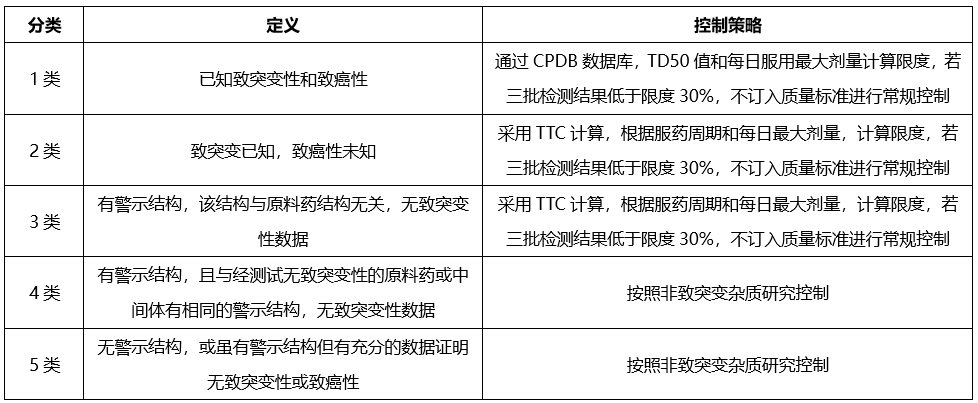
已確定的某些結構基團具有較高的致癌性,即使攝入量低于TTC水平,理論上仍會具有高致癌風險,這類高效致癌性致突變致癌物,被稱為關注隊列,其中包括黃曲霉毒素類,N-亞硝基化合物,烷基-氧化偶氮基化合物。
我們開發致突變雜質相關方法檢測上述致突變雜質,雜質控制策略如下:
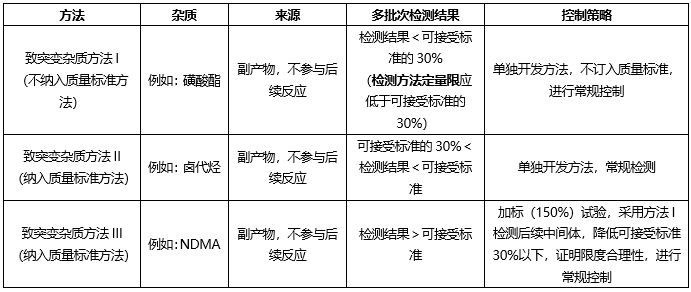
根據起始原料合成工藝、終產品合成工藝,ICH Q3C,確定控制策略如下:
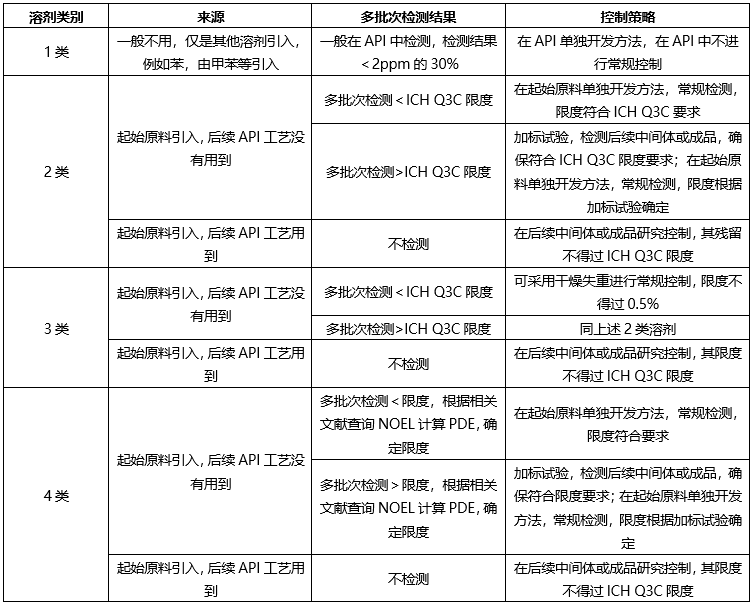
?起始原料控制策略-無機雜質(元素雜質)
根據起始原料合成工藝,如果僅使用鈉鹽,鉀鹽,采用熾灼殘渣進行控制;如果使用特殊元素雜質,需要根據ICH Q3D進行元素雜質控制。
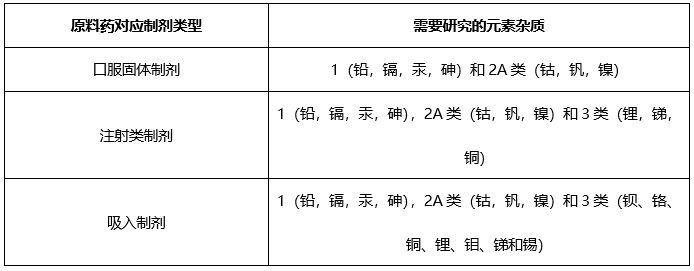
元素雜質(僅針對口服固體原料藥)
根據起始原料合成工藝、終產品合成工藝,根據ICH Q3D,確定控制策略:
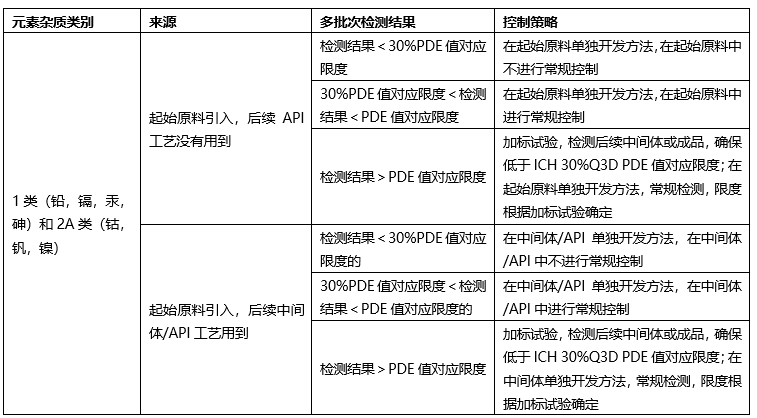
?起始原料的質量標準
至少包含外觀,鑒別,比旋度(若有手性),有關物質(特定雜質,任意單雜和總雜),致突變雜質(若有),殘留溶劑(二類溶劑,若有),干燥失重(控制三類溶劑,若有),熾灼殘渣(無機雜質控制)和含量。
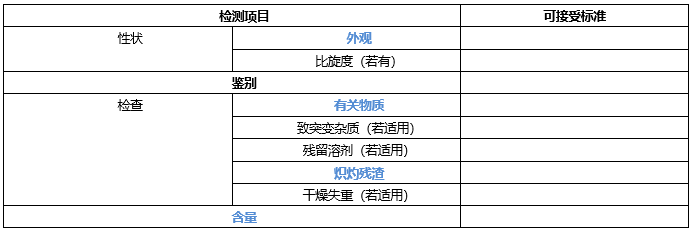
*藍色字體,標準中必須包含項目,黑色字體根據實際檢測結構確定是否增訂入質量標準
根據國內法規,要求對起始原料進行供應商審計,提交審計報告。
起始物料供應商審計目的,可以幫助藥品生產企業確認以下內容,降低注冊風險:
★ 確定供應商提供合成路線是真實的,完整的,質量研究工作沒有遺漏。
★ 現場查看供應商生產情況和質量情況,關注持續供貨能力。
★ 現場簽訂質量協議,明確說明,如果工藝變更,需要提前通知。
★ 現場獲得相關ISO/GMP證書(若有),相關TSE/BSE聲明,OVI聲明(殘留溶劑聲明),元素雜質聲明等。
ICH Q7 活性藥物成分(API)的GMP指南
ICH Q3A 新原料藥中雜質
ICH Q3C 殘留溶劑的指導原則
ICH Q3D 元素雜質指導原則
ICH Q11 原料藥開發和生產
80號文化學藥品新注冊分類申報資料要求
-END-
關于我們:
原料藥研究事業部現有研發人員近百人,近80%為碩士或博士學歷。由具有10年以上國內外項目管理、藥品開發、生產轉化、注冊申報經驗人員作為主要研究和管理者,形成具有集產品立項、高端中間體、工藝開發、質量全面研究、產業化轉移、中美雙報、單制劑原料藥評價于一體的原料藥全產業鏈構架。
事業部由6大中心組成,分別是工藝研發中心、產業化中心、質控中心、雜質中心、注冊中心和技術服務中心。工藝研發中心主要包含抗生素研發平臺、創新工藝研發平臺、復雜藥物分析研發平臺、結晶研發平臺和原料藥粉體學研究平臺。產業化中心主要包含起始原料、API資質控制平臺、工藝驗證、技術轉移風險控制平臺。質控中心主要包含方法學建立和驗證平臺、雜質研究技術包服務平臺。雜質中心主要包括雜質制備、MS檢測和公共對照品控制等。注冊中心注冊經驗豐富,可以承接中美雙報。技術服務中心服務于立項、市場、制劑、采購部等與原料相關的技術支持。
新領先醫藥原料藥事業部可以助力廣大業內中間體生產商實現產業升級為原料藥供應商、助力制藥企業快速確定起始原料供應商、快速完成研發、轉移、注冊申報,獲得生產批件。
轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
