又有 4 個參比制劑未通過審議!(附原因)

4 個未通過審議的品規分別為:
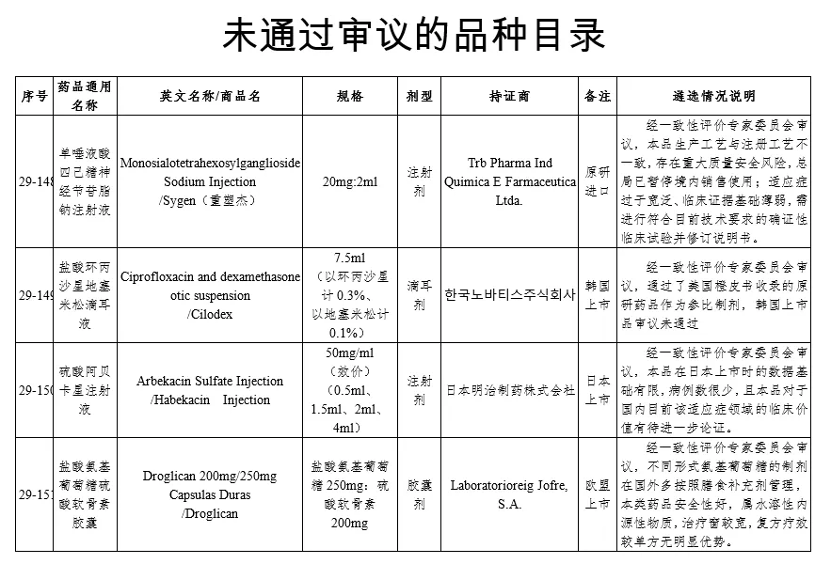
1、單唾液酸四己糖神經節苷脂鈉注射液(20mg:2ml)
持證商:TrbPharma Ind Quimica E Farmaceutica Ltda.(原研進口)
未通過原因:經一致性評價專家委員會審議,本品生產工藝與注冊工藝不一致,存在重大質量安全風險,總局已暫停境內銷售使用;適應癥過于寬泛、臨床證據基礎薄弱,需進行符合目前技術要求的確證性臨床試驗并修訂說明書。
2、鹽酸環丙沙星地塞米松滴耳液(7.5ml(以環丙沙星計0.3%、以地塞米松計0.1%))
持證商:??????????(韓國上市)
未通過原因:經一致性評價專家委員會審議,通過了美國橙皮書收錄的原研藥品作為參比制劑,韓國上市品審議未通過
3、硫酸阿貝卡星注射液(50mg/ml(效價)(0.5ml、1.5ml、2ml、4ml))
持證商:日本明治制藥株式會社(日本上市)
未通過原因:經一致性評價專家委員會審議,本品在日本上市時的數據基礎有限,病例數很少,且本品對于國內目前該適應癥領域的臨床價值有待進一步論證。
4、鹽酸氨基葡萄糖硫酸軟骨素膠囊(鹽酸氨基葡萄糖250mg:硫酸軟骨素200mg)
持證商:LaboratorioreigJofre, S.A.(歐盟上市)
未通過原因:經一致性評價專家委員會審議,不同形式氨基葡萄糖的制劑在國外多按照膳食補充劑管理,本類藥品安全性好,屬水溶性內源性物質,治療窗較寬,復方療效較單方無明顯優勢。
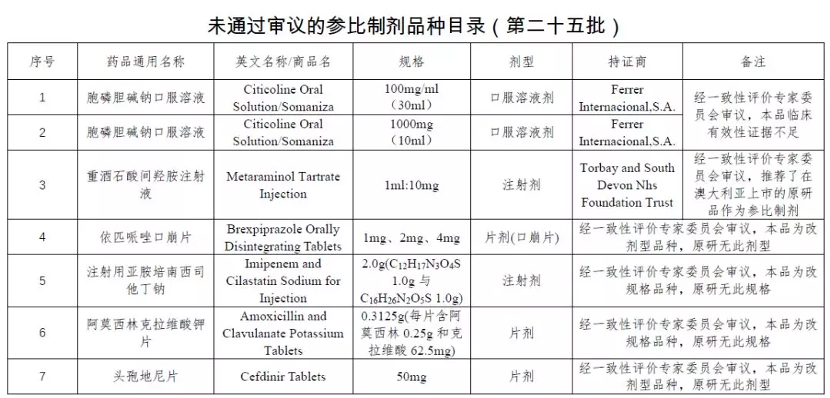
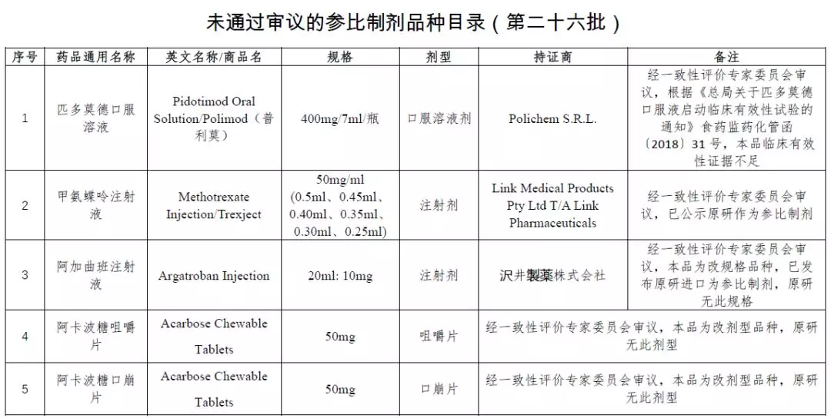
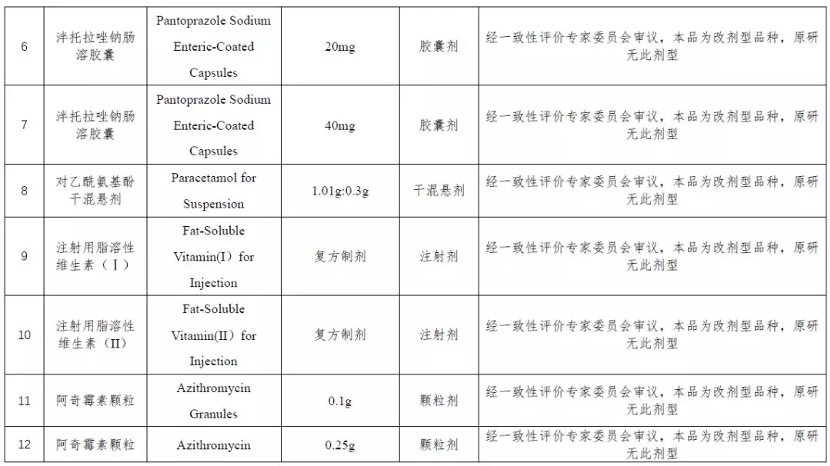
在今年 1 月 10 日,CDE 公示了《化學仿制藥參比制劑目錄》第 25 和 26 批名單征求意見稿中,首次公示未通過審議的參比制劑品種名單,兩批共計 29 個品規未通過審議。
據 Insight 數據庫統計,目前未通過審議的參比制劑達到 33 個。
轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
