重磅:三大征求意見一夕轉正, 化學藥品注射劑一致性評價正式開始!
一、參比制劑選擇成為注射液一致性評價的絕對前提條件
“通告”明確指出藥品上市許可持有人應當依據國家藥品監督管理局發布的《仿制藥參比制劑目錄》選擇參比制劑,并開展一致性評價研發申報。尚未收載入《仿制藥參比制劑目錄》的品種,藥品上市許可持有人應當按照《國家藥監局關于發布化學仿制藥參比制劑遴選與確定程序的公告》(2019年第25號)規定申報參比制劑,待參比制劑確定后開展一致性評價研發申報。
二、明確申報資料要求
《化學藥品注射劑仿制藥質量和療效一致性評價申報資料要求》結合“120號文”和“80號文”的要求,明確了注射劑一致性評價資料要求,更適合注射劑一致性評價的特點。
三、明確注射劑一致性評價的時效
“通告”明確了注射劑一致性評價依然遵循《關于仿制藥質量和療效一致性評價有關事項的公告》(2018年第102號)的相關要求。根據“102號文”規定化學藥品新注冊分類實施前批準上市的含基本藥物品種在內的仿制藥,自首家品種通過一致性評價后,其他藥品生產企業的相同品種原則上應在3年內完成一致性評價。逾期未完成的,企業經評估認為屬于臨床必需、市場短缺品種的,可向所在地省級藥品監管部門提出延期評價申請,經省級藥品監管部門會同衛生行政部門組織研究認定后,可予適當延期。逾期再未完成的,不予再注冊。需要進行一致性評價的企業需要加快腳步了。
四、特殊注射劑研究思路明確
《化學藥品注射劑(特殊注射劑)仿制藥質量和療效一致性評價技術要求》明確了特殊注射劑應基于制劑特性和產品特征,采取逐步遞進的對比研究策略,通常首先開展受試制劑與參比制劑藥學及非臨床的比較研究,然后進行人體生物等效性研究,必要時開展進一步的臨床研究。對于藥學研究、非臨床研究和臨床研究都有了比較明確的要求。

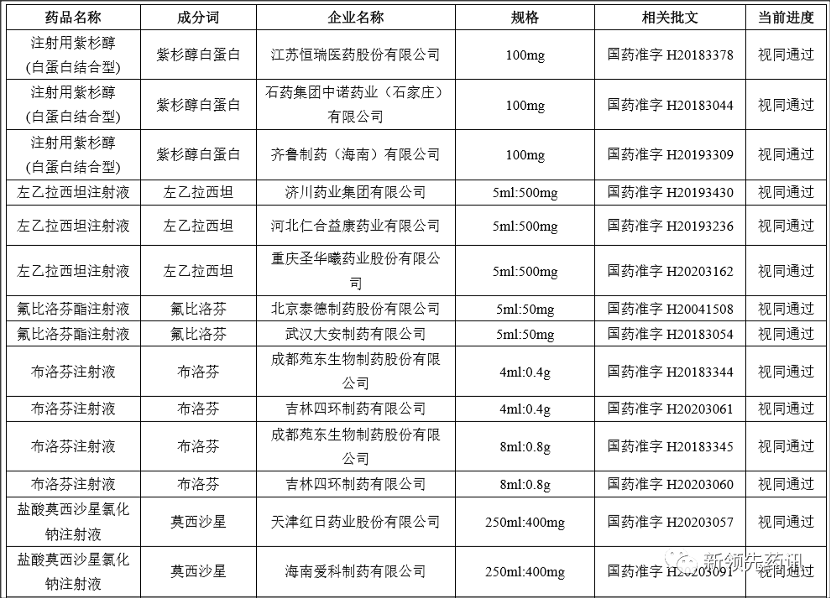
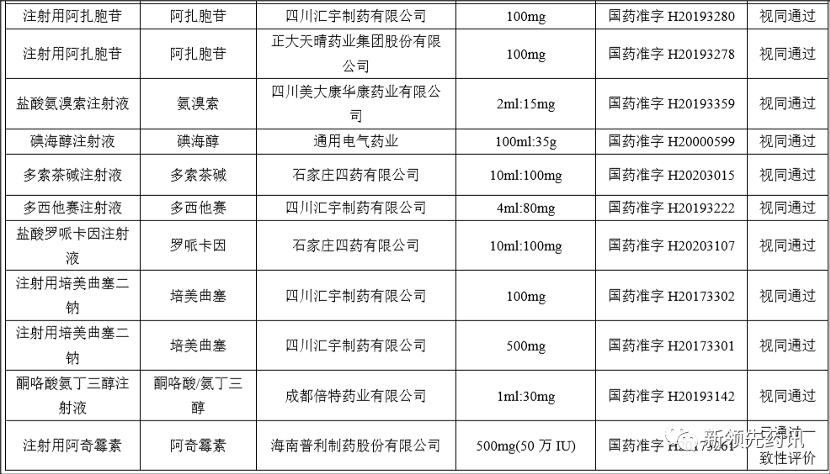
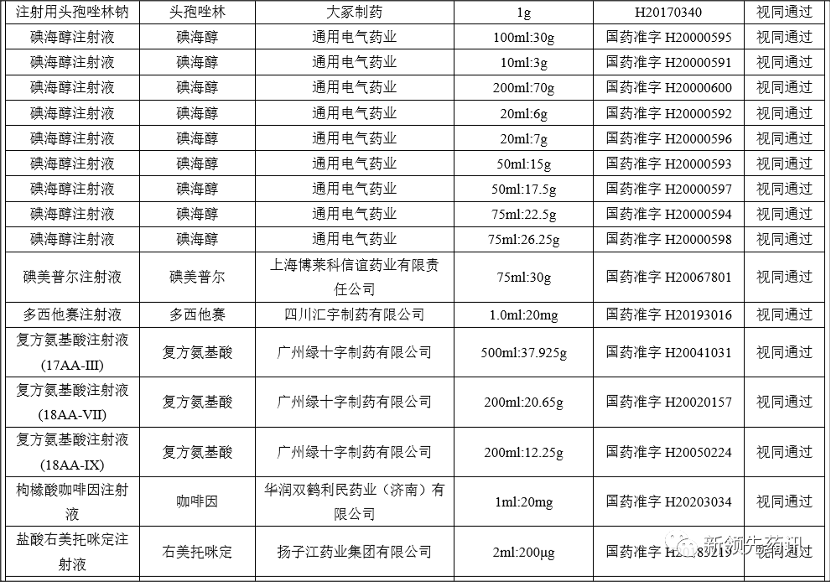
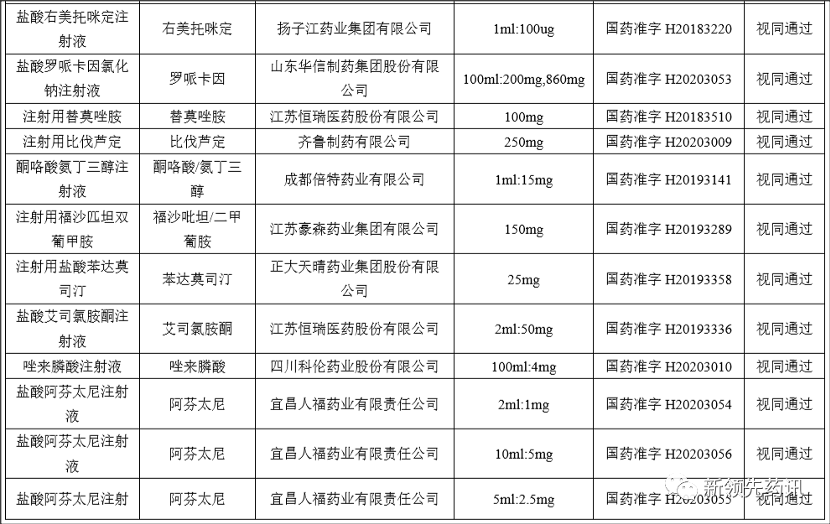
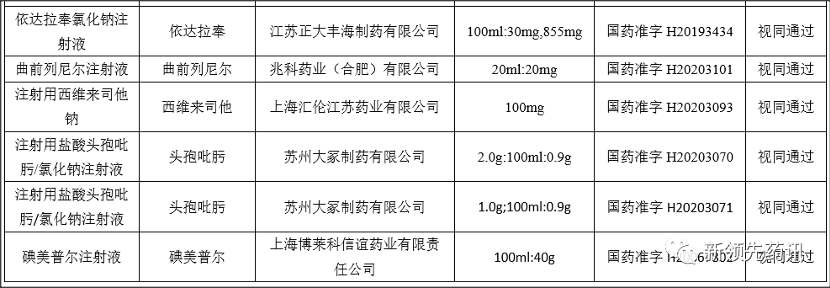
附件:化學藥品注射劑一致性評價進度
轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
