聚焦吸入制劑
一、吸入制劑分類
吸入制劑根據其給藥裝置差異可以分為四大類:干粉吸入劑(DPI)、氣霧劑(MDI)、霧化吸入溶液(NEB)、噴霧劑。
二、吸入制劑優勢
1、起效迅速
由于人體肺部具有巨大的可用于藥物吸收的表面積以及豐富的毛細血管,并且從肺泡表面到毛細血管的運轉距離極短,因此藥物一旦到達肺泡即可迅速被吸收和轉運,故吸入制劑起效迅速。
2、靶向性,毒副作用小
由于吸入制劑直接作用于肺部,提高藥物在靶器官的聚集,因此增加藥物療效的同時減少了藥物毒性與不良反應。
3、生物利用度高
肺部直接入血,無首過效應,生物利用度高。
4、患者依從性好
氣霧劑、干粉劑便于攜帶,方便患者操作并且劑量準確。
三、市場概況
1、流行病學
隨著空氣污染程度增加,支氣管哮喘(Asthma)和慢性阻塞性肺病(COPD)等呼吸道疾病的發病率呈現持續高增長,同時ACOS(重疊綜合癥)人群也會越來越多。據推測,全球有3.6億人患有支氣管哮喘,近3.8億人患有慢性阻塞性肺病,其中有6500萬人患有中重度慢性阻塞性肺病。
國內情況也不容樂觀,根據王辰院士團隊2019 年在《柳葉刀》雜志發布的《Prevalence, risk factors, and management of asthma in China》顯示,我國 20 歲及以上人群哮喘患病率為 4.2%,患者總人數4570萬(男性2570萬,女性2000萬);慢阻肺患病率為8.6%,總人數達有9990萬名(男性6840萬,女性3150萬),其中40歲及以上患病率達到13.7%,男性患者數為女性的2.2倍,COPD已成為僅次于高血壓、糖尿病的中國第三大常見慢性病。
2、市場格局
在市場方面,IQVIA報告顯示,2019年全球吸入制劑的市場份額高達480億美元,6年復合增長率為+6.99%。全球吸入制劑藥物的應用場景,主要來自支氣管哮喘Asthma/慢阻肺COPD的防治(約93%市場份額)、肺動脈高壓治療,以及吸入麻醉及咳嗽的運用。
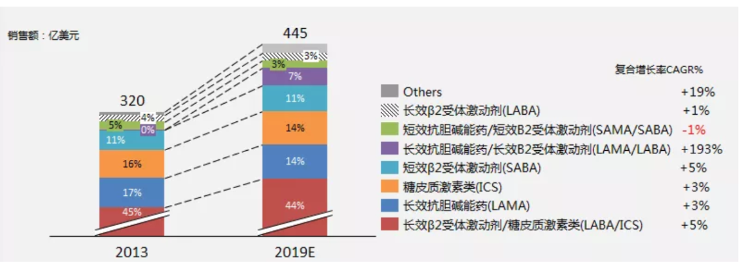
中國城市公立醫院統計,2018年國內氣霧劑、噴霧劑和粉霧劑市場容量為122億元,近5年復合增長率(GAGR)高達+16.38%。
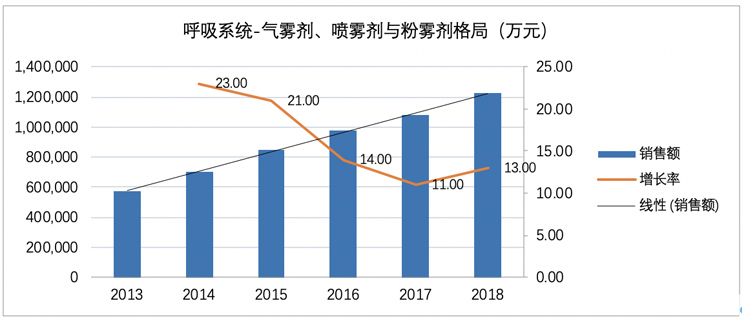
在劑型細分領域,IQVIA分析報告顯示,全球各劑型處方量中氣霧劑占55%,粉霧劑占35%,霧化溶液占10%;銷售金額中,氣霧劑占32%,粉霧劑占46%,霧化溶液占22%,可見全球氣霧劑的銷售量最大,而粉霧劑的銷售金額最大,主要原因為氣霧、粉霧劑型的市場先發優勢。
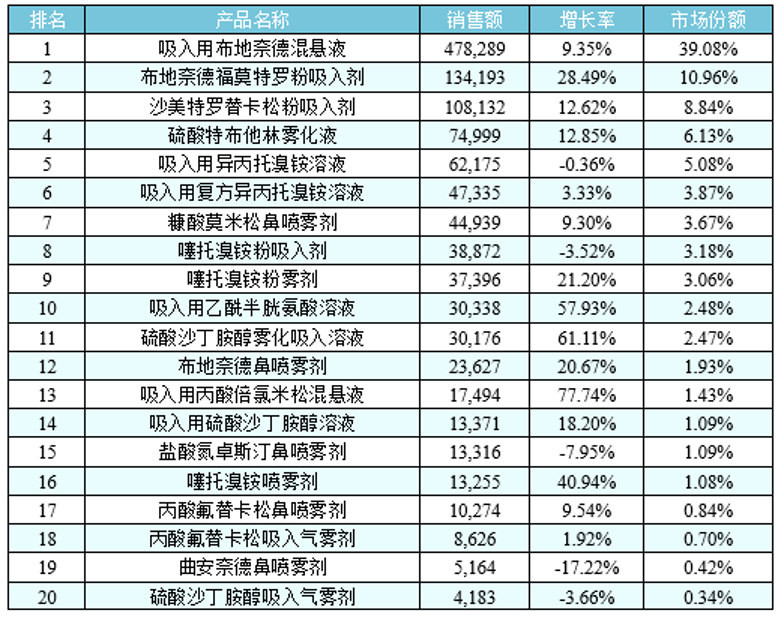
中國市場呈現不同的情況,據中國城市公立醫院統計,2018年呼吸系統用藥之氣霧劑、噴霧劑與粉霧劑產品名稱TOP20格局(下表所示)中霧化溶液占62%的市場,粉霧劑占25%,氣霧劑只占2%不到,說明中國吸入制劑市場具有其內在的特點,其中霧化吸入溶液代表產品在國內均呈增長趨勢。
四、品種介紹
中國及歐美上市治療哮喘和慢性阻塞性肺病的藥物類別主要有:長/短效β2受體激動劑藥物 、長/短效抗膽堿能藥物、糖皮質激素、白三烯受體拮抗劑、細胞因子抑制劑等。
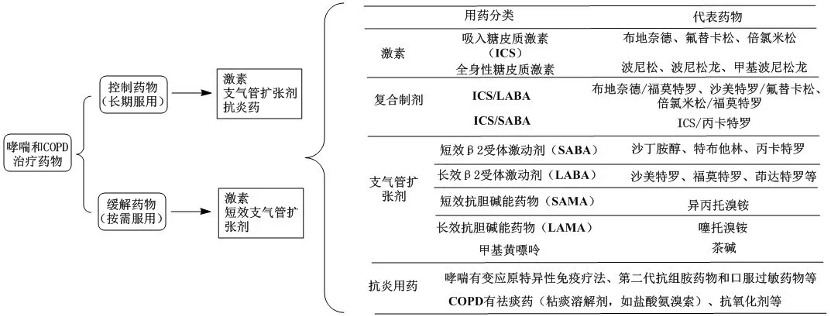
目前國內吸入制劑研發熱度較高品種:
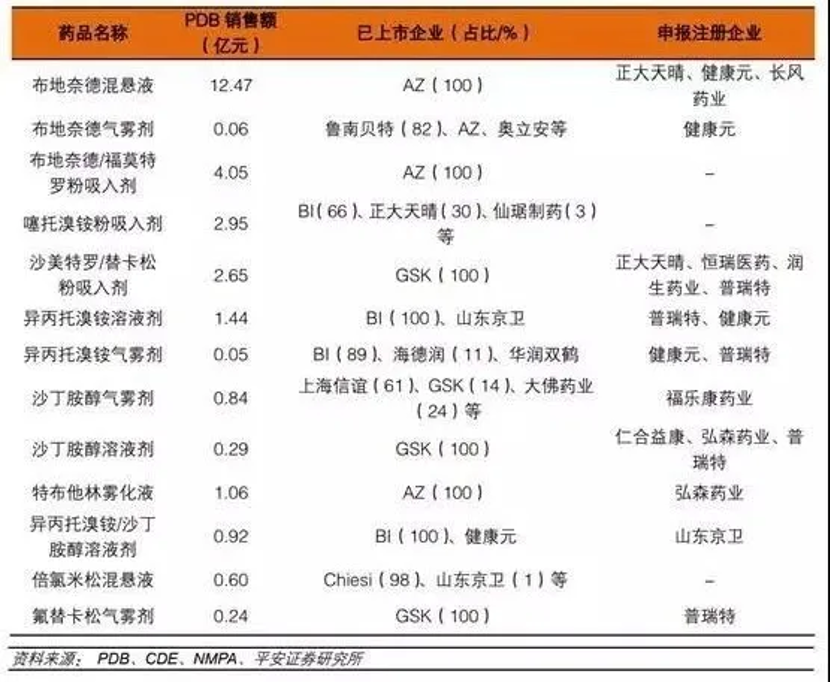
從以上數據可知,目前布地奈德混懸液、布地奈德福莫特羅粉吸入劑、沙美特羅替卡松粉吸入劑等重磅品種國內僅原研獲批,市場份額完全被原研企業占據。國內企業正在積極布局,一旦首仿成功,有望快速實現進口替代。從已上市和研發布局情況來看,正大天晴、健康元、恒瑞醫藥、長風藥業、普瑞特、山東京衛、仙琚制藥等處于領先位置。
五、法規要求
吸入療法有著悠久的歷史,公元前 2600 年《黃帝內經》中就有使用麻黃的記載,公元前 1554 年的埃伯斯伯比書(Ebers papyrus,古埃及最早記錄藥學知識的書)中,就記載了通過吸入莨菪煙霧來治療呼吸困難。西方現代吸入給藥治療可追溯到20世紀50年代。在現代吸入制劑近70年的發展歷史中,歐美日等醫藥發達國家也相繼制定了近20個相關的指導原則及指南,最早一部指南應追溯到1991年10月11日美國聯邦登記處公布的<56 FR 51354>指南:Guidance for Industry Sterility Requirement for Aqueous-Based Drug Products for Oral Inhalation -Small Entity Compliance Guide(以水為基質的口服吸入藥物產品工業無菌要求-小體積合規指南),明確規定所有處方和非處方水性藥物產品用于口服吸入都是無菌的。
中國(CDE)也于2007年參考國內外相關指導原則和文獻的基礎上,通過分析質量控制研究與安全有效性和質量可控性之間的內在關系,制定《吸入制劑質量控制研究技術指導原則》,旨在為藥物研發者在吸入制劑質量控制研究過程提供基本的技術指導。
隨后在2015版《中國藥典》四部中增加了吸入制劑劑型,詳細描述了其藥學研究階段從原料藥控制到霧化特性研究相關的檢測指標和檢測方法,并明確“遞送速率”、“遞送總量”、“微細粒子劑量”及“無菌”等檢測項應列入質量標準。
2019年8月2日,CDE 發布了《經口吸入制劑仿制藥藥學和人體生物等效性研究指導原則(征求意見稿)》,旨在針對經口吸入制劑仿制藥的藥學和人體生物等效性研究等方面提供技術指導,提出了仿制藥品在開發的階段藥學和人體生物等效性研究的方法,為國內吸入制劑藥物研發指明方向。
縱觀各國關于吸入制劑指導原則及指南要求,全球已基本達成共識,主要涉及無菌保障、霧化特性質量研究和生物等效性研究三個方面,匯總如下:

六、關于我們
北京新領先醫藥科技發展有限公司于2019年初成立了吸入制劑事業部,為藥學板塊八大事業部之一,專業從事吸入制劑從生產線設計、仿制藥及改良型創新藥開發、產業化技術轉移到注冊申報研發服務,為客戶提供完整解決方案。
吸入制劑事業部在國際認可的ISO9001質量管理體系下運行,組織架構、管理制度和研發流程成熟。現有研發人員近50人,50%以上為碩士學歷,主要研究及管理人員具有10年以上國內外項目管理、藥品開發、生產轉化及注冊申報經驗。
事業部具有完整的實驗室和符合GMP要求的中試放大制劑設備,包括配液系統(具有加熱和冷卻功能)、囊式過濾器、高剪切均質機、微射流納米均質機、安瓿熔封機、濕熱滅菌柜、無菌隔離器、吹灌封(BFS)一體機等,能滿足吸入制劑藥學研究階段各項需求,并配備良好的霧化特性檢測設備,液相色譜、氣相色譜和大型質譜類質量檢測設備及符合法規的網絡版數據管理系統,為整個藥學研發部分提供保障。
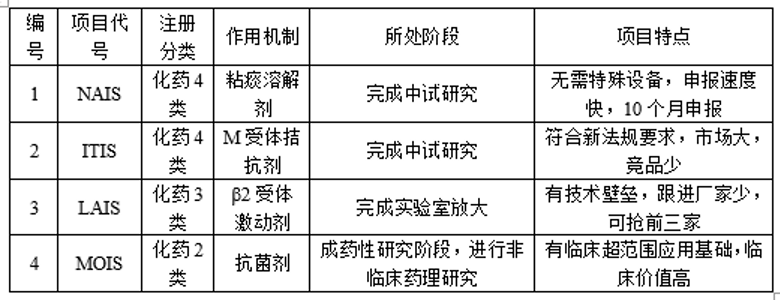
目前吸入制劑事業部在研品種10余個,多個品種已進入產業化階段,積累了豐富的產品開發和申報經驗,能夠高效的幫助企業完成申報注冊工作,獲得生產批件。
部分品種簡介如下:
轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
